Принцип Паули и Хунда.
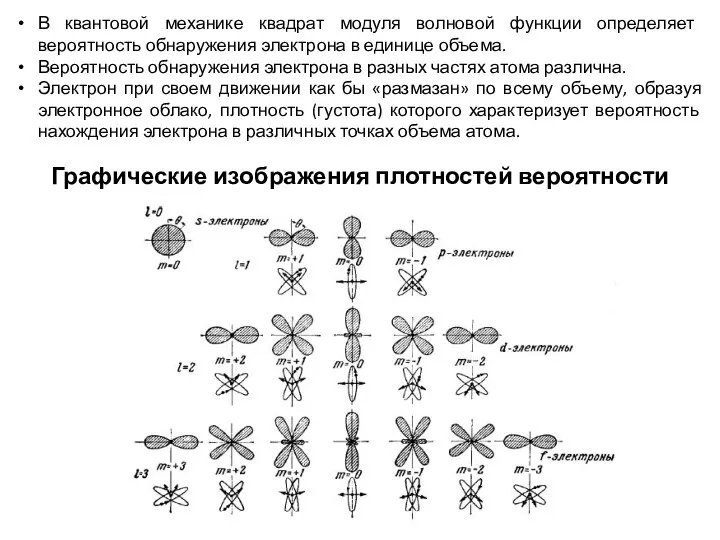
Распределение электронов по энергетическим уровням атома
Состояние каждого
электрона в атоме характеризуется четырьмя квантовыми числами:
главным n (n = 1, 2, 3,…)
орбитальным l (l = 0, 1, 2,... , n-1),
магнитным ml (ml = -l,…, - l, 0, +1,…, +l),
спиновым ms (ms = +1/2, -1/2).
Паули
Вольфганг
(1900 - 1958)
В нормальном (невозбужденном) состоянии атома электроны должны располагаться на самых низких доступных для них энергетических уровнях.
Поэтому, казалось бы, в любом атоме в нормальном состоянии все электроны должны находиться в состоянии
1s (n=1, l=0).
Однако опыт показывает, что это не так.







 Урок изучения нового материала 7класс Первухина Надежда Геннадьевна Учитель физики МКОУ СОШ №2 с. Туринская Слобода Свердловско
Урок изучения нового материала 7класс Первухина Надежда Геннадьевна Учитель физики МКОУ СОШ №2 с. Туринская Слобода Свердловско Механика упругих тел
Механика упругих тел Движение жидкости Уравнение. Бернулли
Движение жидкости Уравнение. Бернулли Объектное демонстрирование эффекта Доплера для звуковых волн
Объектное демонстрирование эффекта Доплера для звуковых волн Оптические свойства системы линз, сложенных вплотную
Оптические свойства системы линз, сложенных вплотную Ультразвук Ультразвук, упругие колебания и волны с частотами приблизительно
Ультразвук Ультразвук, упругие колебания и волны с частотами приблизительно Виды диэлектриков и их поляризация
Виды диэлектриков и их поляризация Изобретение радио А.С. Поповым
Изобретение радио А.С. Поповым Деформация и разрушение металлов. Материаловедение
Деформация и разрушение металлов. Материаловедение Обзор теорий электрического пробоя твердых диэлектриков Выполнил студент группы 5А1В Зубков А.В. Проверил преподаватель Мыт
Обзор теорий электрического пробоя твердых диэлектриков Выполнил студент группы 5А1В Зубков А.В. Проверил преподаватель Мыт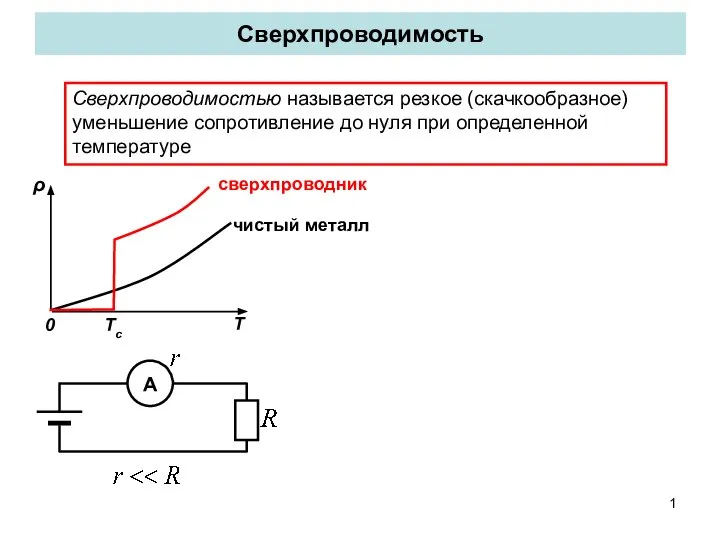 Сверхпроводимость. Криопроводники
Сверхпроводимость. Криопроводники Презентация на тему: Ядерные реакции
Презентация на тему: Ядерные реакции Електричний струм у газах
Електричний струм у газах Презентация по физике "Параллельное соединение проводников" - скачать
Презентация по физике "Параллельное соединение проводников" - скачать  Основы электротехники
Основы электротехники Принципы работы рычага и его виды
Принципы работы рычага и его виды Презентация по физике "Эектрическая машина" - скачать
Презентация по физике "Эектрическая машина" - скачать  Защитные покрытия. Восстановление корпусов насосов
Защитные покрытия. Восстановление корпусов насосов Физические свойства воды в разных агрегатных состояниях
Физические свойства воды в разных агрегатных состояниях Баламалы энергия көздері
Баламалы энергия көздері Исследовательский проект по физике: Двигатель Стирлинга
Исследовательский проект по физике: Двигатель Стирлинга Урок решения задач по теме: «Средняя скорость» (7 класс)
Урок решения задач по теме: «Средняя скорость» (7 класс) Аттестационная работа. Проблемно-ориентированный урок как средство формирования исследовательских навыков на уроках физики
Аттестационная работа. Проблемно-ориентированный урок как средство формирования исследовательских навыков на уроках физики Законы постоянного тока
Законы постоянного тока Презентация по физике Молекулярно-кинетическая теория
Презентация по физике Молекулярно-кинетическая теория  История развития механики
История развития механики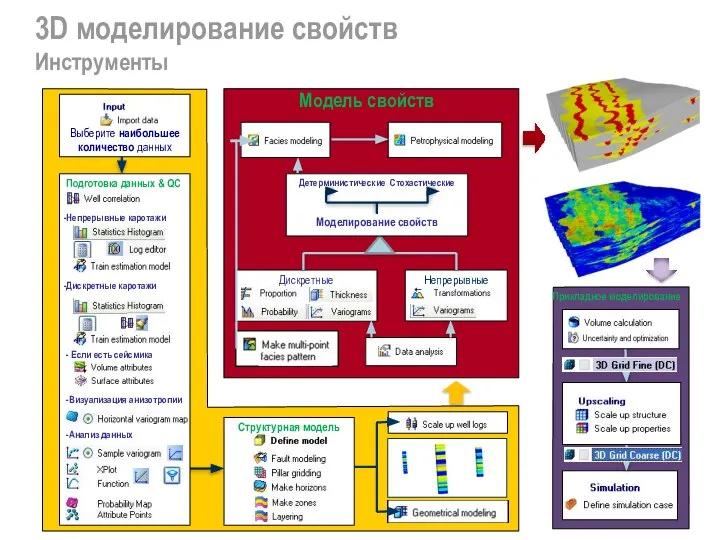 3D моделирование свойств. Инструменты
3D моделирование свойств. Инструменты Презентация по физике Аморфные тела
Презентация по физике Аморфные тела