Содержание
- 2. Молекулярно-кинетические свойства свойства, обусловленные числом (концентрацией) частиц, участвующих в тепловом движении. В истинных растворах - числом
- 3. Изобретение ультрамикроскопа (1903) позволило непосредственно наблюдать движение отдельных коллоидных частиц и связать интенсивность движения с размером
- 4. Молекулярно-кинетические свойства (общие): диффузия, осмотическое давление, понижение давления пара над раствором, изменение температур кипения и замерзания
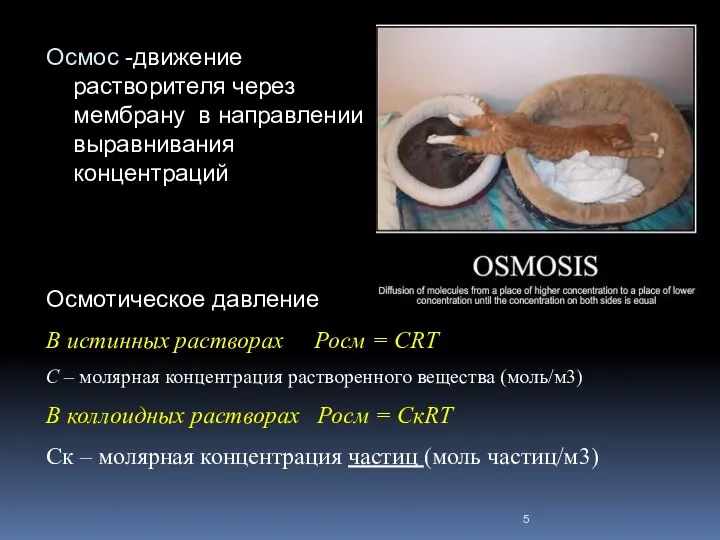
- 5. Осмос -движение растворителя через мембрану в направлении выравнивания концентраций Осмотическое давление В истинных растворах Росм =
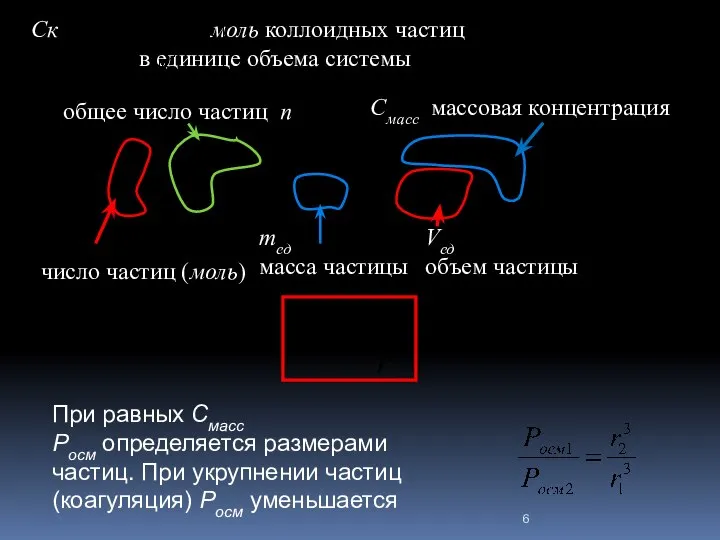
- 6. Ск моль коллоидных частиц в единице объема системы число частиц (моль) общее число частиц n mед
- 7. Диффузия распространение вещества вследствие теплового движения его частиц. Ведёт к равномерному распределению вещества по всему занимаемому
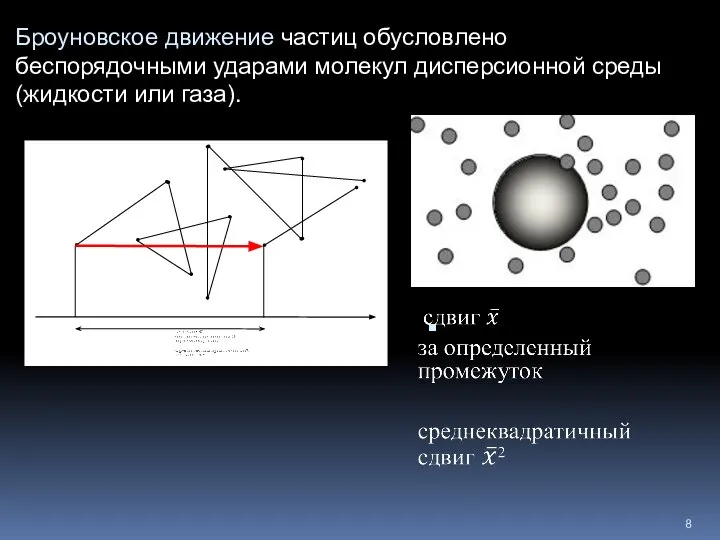
- 8. Броуновское движение частиц обусловлено беспорядочными ударами молекул дисперсионной среды (жидкости или газа).
- 9. Связь среднеквадратичного сдвига частицы с коэффициентом диффузии А. Эйнштейн, 1905 г. М. Смолуховский, Выполнимость этого уравнения
- 10. Седиментация –оседание частиц В состоянии равновесия F тяж = F сопр (вязкость), скорость оседания u =
- 11. Седиментационный анализ – определение размера (массы) частиц по скорости оседания Скорость u - путь, пройденный частицей
- 12. частицы r 1мкм оседают в поле силы тяжести на несколько см за сутки, в центрифуге –
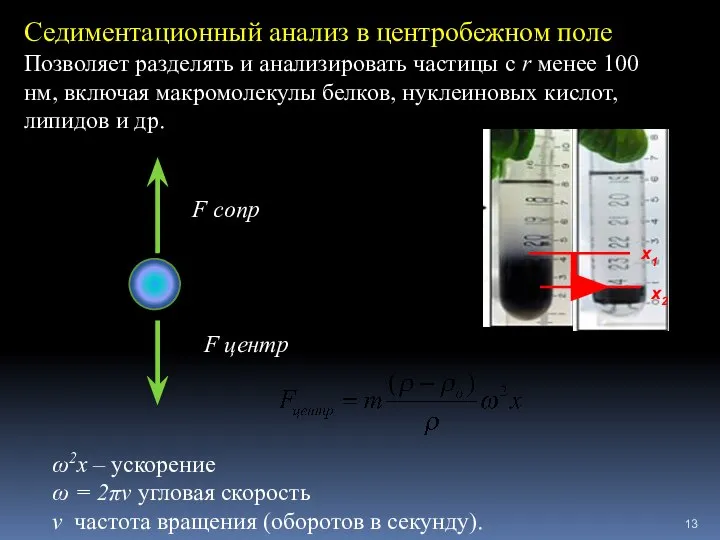
- 13. F cопр F центр Седиментационный анализ в центробежном поле Позволяет разделять и анализировать частицы с r
- 15. Соотношение скорости оседания dx/dτ к ускорению ω2x называют коэффициентом седиментации: Соотношение скорости оседания dx/dτ к ускорению
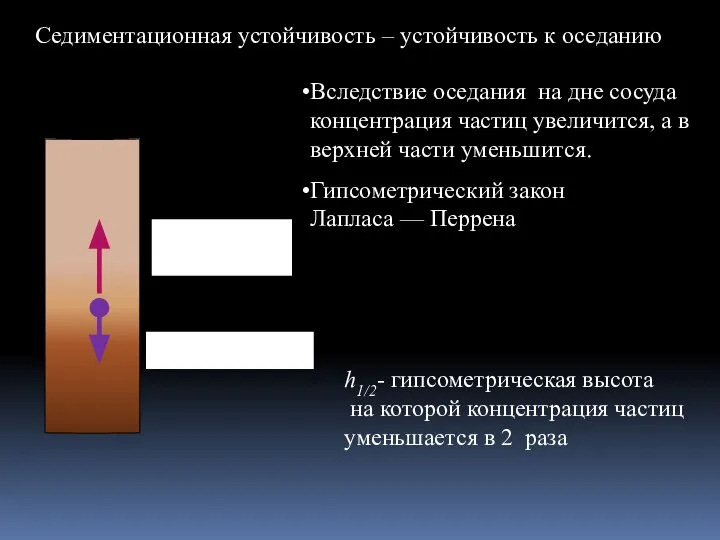
- 16. Вследствие оседания на дне сосуда концентрация частиц увеличится, а в верхней части уменьшится. Гипсометрический закон Лапласа
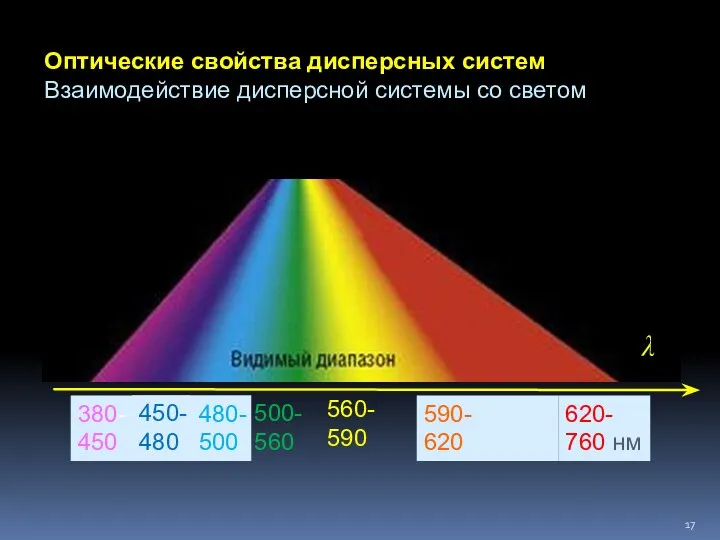
- 17. 380- 450 620- 760 нм 450- 480 480- 500 500- 560 560- 590 590- 620 λ
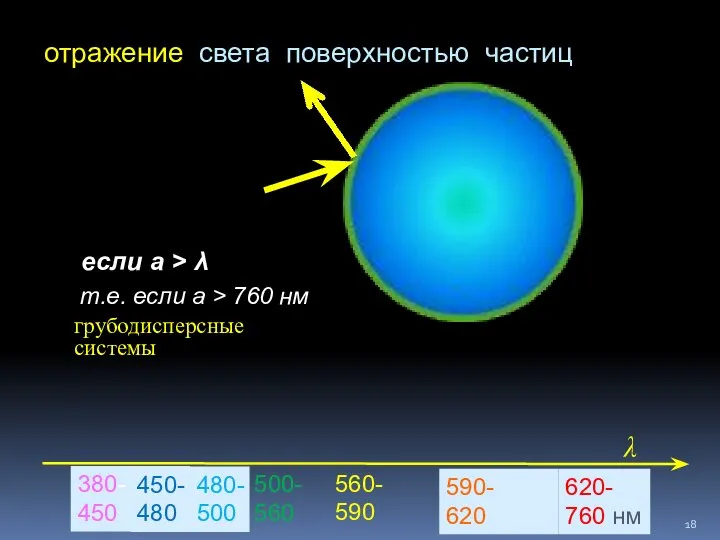
- 18. отражение света поверхностью частиц если а > λ 380- 450 620- 760 нм 450- 480 480-
- 19. прохождение света через систему если а (менее 10 нм = низкомолекулярные растворы = дисперсионная среда, малая
- 20. поглощение света Частицы могут абсорбировать (поглощать) или весь падающий свет или его часть. Воспринимается оставшаяся часть
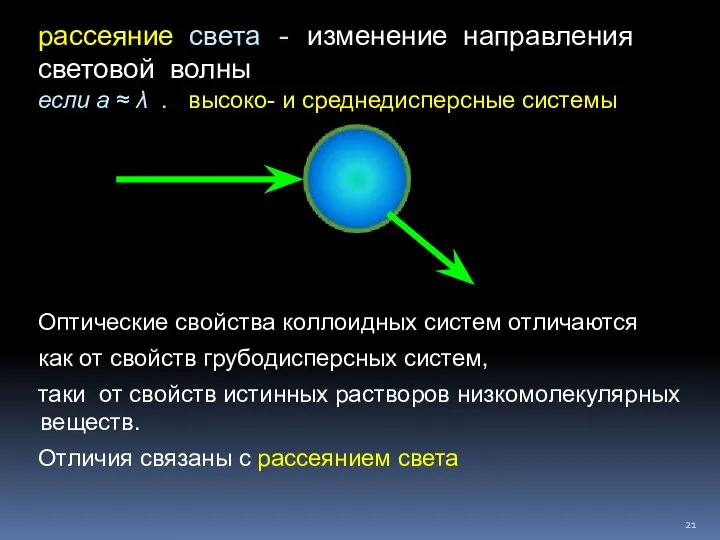
- 21. рассеяние света - изменение направления световой волны если а ≈ λ . высоко- и среднедисперсные системы
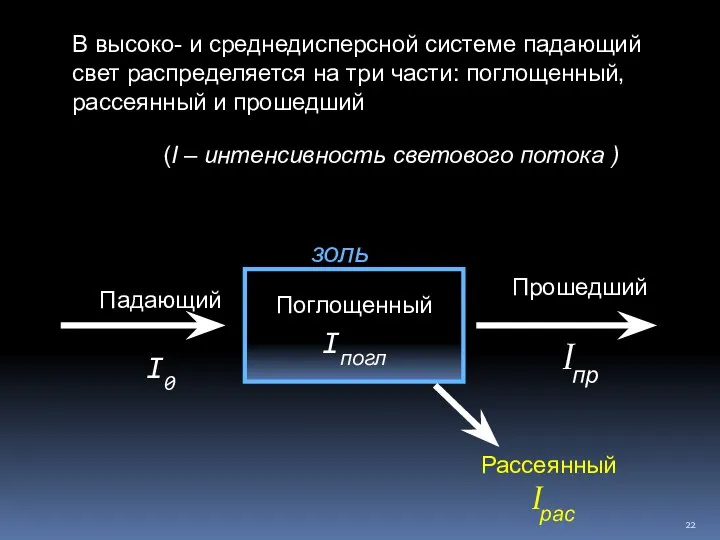
- 22. В высоко- и среднедисперсной системе падающий свет распределяется на три части: поглощенный, рассеянный и прошедший Падающий
- 23. Характерные проявления оптических свойств дисперсных систем опалесценция, эффект Тиндаля, окраска окраска определяется рассеянием света (если нет
- 24. Опалесценция переливчатое свечение, наблюдается при боковом освещении. Связано с рассеянием света
- 25. Эффект Тиндаля John Tyndall При освещении коллоидного раствора сбоку пучком света наблюдается яркий светящийся след —
- 26. Эффект Тиндаля в воздушной среде
- 27. Интенсивность рассеяния света уравнение Рэлея Iрас — интенсивность рассеянного света ; I0 — интенсивность падающего света;
- 28. Измеряя Iрас можно экспериментально определить концентрацию C или их размер d Нефелометрия . Приборы, применяемые для
- 29. Лучше рассеивается короткая (красная)часть спектра
- 30. Оптические методы исследования дисперсных систем Оптический микроскоп Разрешающая способность (различимое расстояние между точками) : λ —
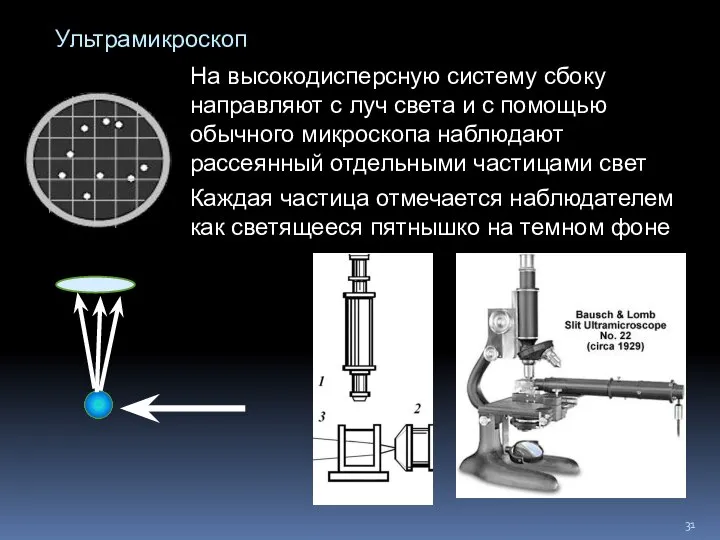
- 31. Ультрамикроскоп Каждая частица отмечается наблюдателем как светящееся пятнышко на темном фоне На высокодисперсную систему сбоку направляют
- 32. Richard A. Zsigmondy Properties of colloids Nobel Lecture, December 11, 1926 Even in prehistoric times the
- 33. Электронный микроскоп (теоретически) на практике 0,2-0,3 нм Длина волны электрона 5 ∙ 10-11м. Ход лучей в
- 34. Просвечивающие электронные микроскопы
- 35. Сканирующий электронный микроскоп Принцип работы : сканирование поверхности образца электронным пучком, анализ отраженных от поверхности частиц
- 37. Скачать презентацию























 Техническое обслуживание и диагностирование неисправностей сельскохозяйственных машин и механизмов;
Техническое обслуживание и диагностирование неисправностей сельскохозяйственных машин и механизмов; Масса тела. Плотность вещества
Масса тела. Плотность вещества Проверочные работы по физике для 7 – 8 класса
Проверочные работы по физике для 7 – 8 класса Химические методы получения нанопорошков: осаждение из растворов
Химические методы получения нанопорошков: осаждение из растворов Кулон Шарль Огюстен
Кулон Шарль Огюстен Презентация к работе «Воздействие музыкального звука разных частот на растения» Автор: Еретина Валентина, 9 «а» класс лицея-инте
Презентация к работе «Воздействие музыкального звука разных частот на растения» Автор: Еретина Валентина, 9 «а» класс лицея-инте Презентация по физике "Электромагнитные волны" - скачать
Презентация по физике "Электромагнитные волны" - скачать  Машинаның теңестірілуі
Машинаның теңестірілуі Электромагнитные взаимодействия, размеры и форма ядер
Электромагнитные взаимодействия, размеры и форма ядер Кристаллические и аморфные тела
Кристаллические и аморфные тела Решение задач на применения закона сохранения импульса
Решение задач на применения закона сохранения импульса Дослідження пружних властивостей плоских пластин за допомогою фігур Хладні
Дослідження пружних властивостей плоских пластин за допомогою фігур Хладні Классическая электродинамика. Дополнительные главы физики. Уравнения Максвелла
Классическая электродинамика. Дополнительные главы физики. Уравнения Максвелла Көчләрне кушу .Бердәй тәэсир итүче көч
Көчләрне кушу .Бердәй тәэсир итүче көч Сложное движение точки. (Лекция 4, кафедра теоретической механики)
Сложное движение точки. (Лекция 4, кафедра теоретической механики) Система с использованием ПИД-регулятора для задачи следования по линии
Система с использованием ПИД-регулятора для задачи следования по линии Электроннолучевая обработка
Электроннолучевая обработка Закон всемирного тяготения
Закон всемирного тяготения Паровая машина. Паровой двигатель Уатта.
Паровая машина. Паровой двигатель Уатта.  Сила упругости. Закон Гука
Сила упругости. Закон Гука Исаак Ньютон
Исаак Ньютон Расчет сопротивления проводника. Удельное сопротивление Горбунова В.А учитель физики МБОУ Черемуховская СОШ Новошешминского р
Расчет сопротивления проводника. Удельное сопротивление Горбунова В.А учитель физики МБОУ Черемуховская СОШ Новошешминского р Конструкции высоковольтных электрических аппаратов. Разъединители. (Лекция 8)
Конструкции высоковольтных электрических аппаратов. Разъединители. (Лекция 8) Научно-исследовательская работа по физике на тему: Силы
Научно-исследовательская работа по физике на тему: Силы Презентация по физике "Разновидности катушек индуктивности" - скачать бесплатно
Презентация по физике "Разновидности катушек индуктивности" - скачать бесплатно Средства радиационного нагрева
Средства радиационного нагрева Электрический ток в различных средах
Электрический ток в различных средах Конденсаторы
Конденсаторы