Содержание
- 2. Тема 11. Феноменологическая термодинамика (ТД) 1. Термодинамическая система (ТДС). 2. Энергия термодинамической системы, работа и теплота.
- 3. 1 учебный вопрос: Термодинамическая система (ТДС). Пример – газ в цилиндре под поршнем. Параметры состояния ТДС:
- 4. ТДС, в которых параметры состояния имеют определенные значения, одинаковые по всей системе и не меняющиеся со
- 6. Термодинамический процесс (ТДП) – переход ТДС из одного состояния в другое. ТДП изображается графически на диаграммах.
- 7. Равновесные процессы обратимы.
- 9. 2 учебный вопрос: Энергия термодинамической системы, работа и теплота. Энергия – это количественная мера движения материи.
- 10. U газа включает: - кинетическую энергию поступательного и вращательного движения молекул; - кинетическую энергию колебательного движения
- 11. Внутренняя энергия идеального газа: (МКТ17) Работа – это способ передачи энергии, связанный с изменением внешних параметров
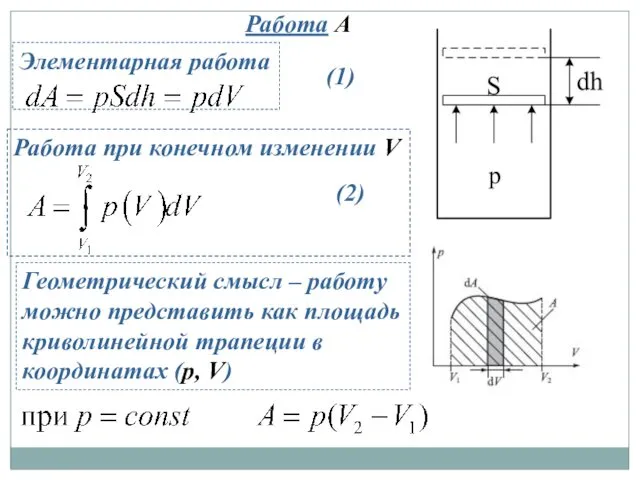
- 12. Работа A Элементарная работа Работа при конечном изменении V Геометрический смысл – работу можно представить как
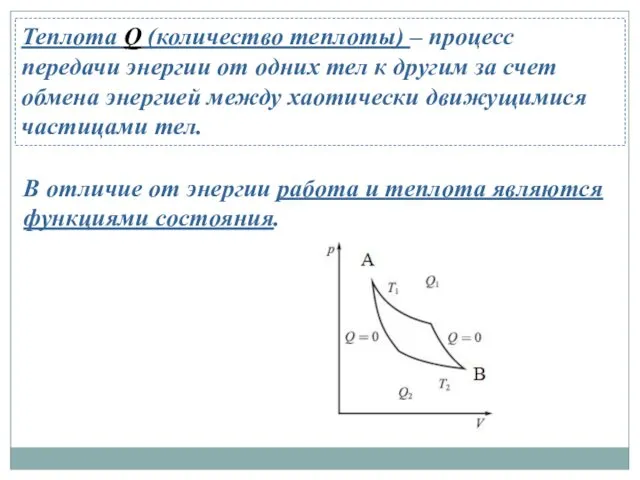
- 13. Теплота Q (количество теплоты) – процесс передачи энергии от одних тел к другим за счет обмена
- 14. Теплоемкость Передача тепловой энергии (теплоты) сопровождается изменением температуры тела. Теплоемкость С – скалярная физическая величина, характеризующая
- 15. Полная теплоемкость (теплоемкость тела) спол численно равна количеству тепла, которое необходимо сообщить системе, чтобы повысить ее
- 16. Молярная теплоемкость С - теплоемкость одного моля вещества: (5) (4) и (5) → (6)
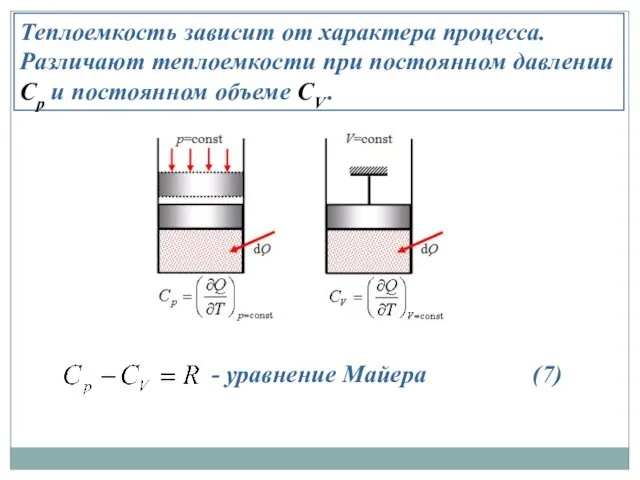
- 17. Теплоемкость зависит от характера процесса. Различают теплоемкости при постоянном давлении Cp и постоянном объеме CV .
- 18. (8) (9) (10)
- 19. 3 учебный вопрос: Первое начало термодинамики В основе термодинамики лежат два закона – два начала термодинамики.
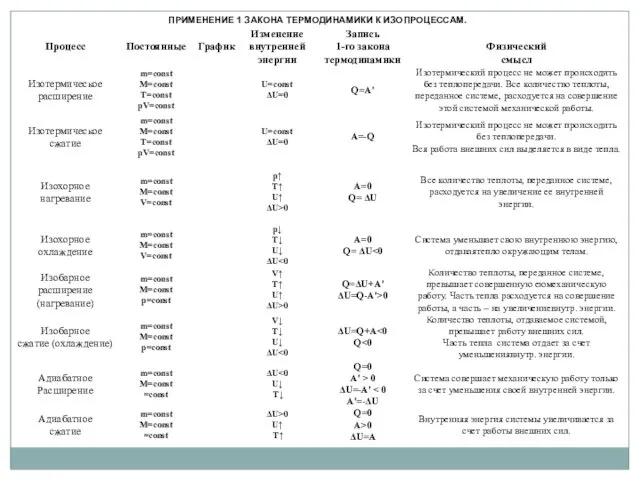
- 20. Количество теплоты, сообщенное системе, идет на приращение ее внутренней энергии и на совершение работы над внешними
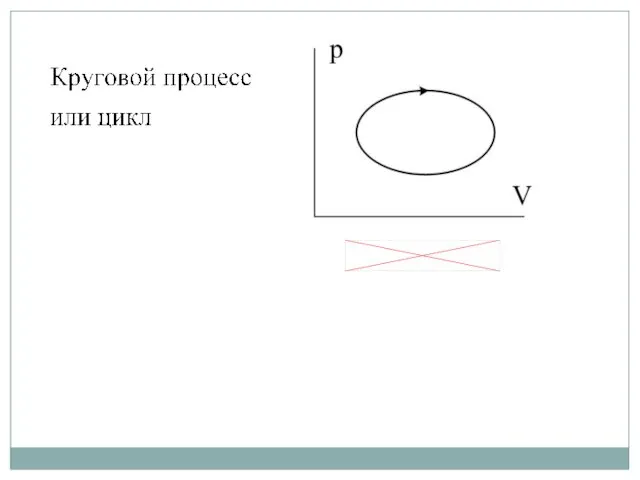
- 21. Если система работает по замкнутому термодинамическому процессу (циклу), то В тепловых двигателях невозможно совершить работу, превышающую
- 22. Вычисление теплоемкостей Ср , СV 1. Изохорный процесс (V = const) (МКТ17) (12) (13), (13а) (10)
- 23. 2. Изобарный процесс (p = const) (14) (10) (13) (М-К)
- 24. Пусть (15) (16), (16а) Майер (12), (14)→ (17)
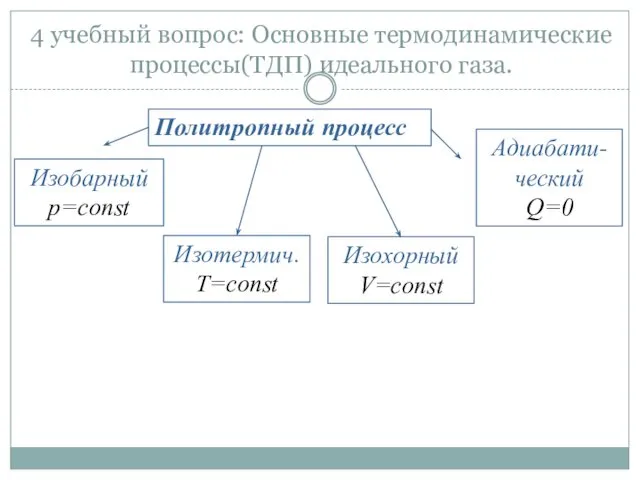
- 27. 4 учебный вопрос: Основные термодинамические процессы(ТДП) идеального газа. Политропный процесс Изотермич. T=const Изобарный p=const Адиабати-ческий Q=0
- 28. Политропным называется равновесный обратимый процесс, удовлетворяющий условиям: 1. рабочее тело – идеальный газ; 2. z −
- 29. 1 начало ТД + ур-е М-К => (19) (20) где (21) уравнения политропы показатель политропы (22)
- 30. Теплота в политропном процессе Работа в политропном процессе (23) (24а) (24б) (10) (22) (19) (М-К)
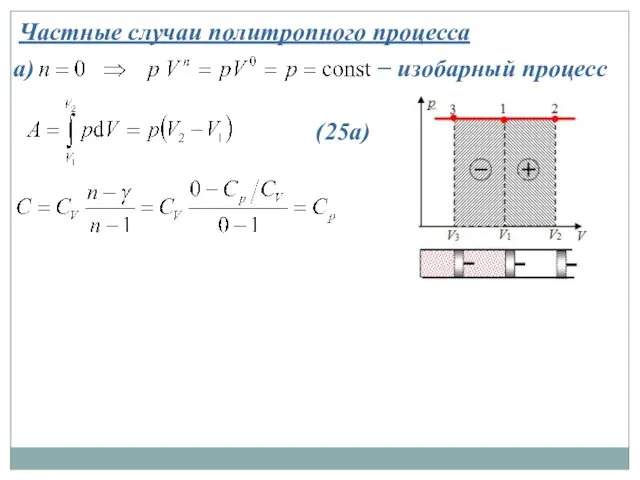
- 31. Частные случаи политропного процесса а) − изобарный процесс (25а)
- 32. Частные случаи политропного процесса б) − изотермич. процесс Это бесконечно медленный процесс (25б)
- 33. Частные случаи политропного процесса в) − изохорный процесс т.е. все подводимое тепло идет на увеличение внутренней
- 34. Частные случаи политропного процесса г) − адиабатный процесс Это бесконечно быстрый процесс (25г) т.е. работа расширения
- 35. 5 учебный вопрос: Тепловые и холодильные машины. Цикл Карно. Циклом называется круговой процесс, при котором система,
- 36. Nicolas Léonard Sadi Carnot 1 июня 1796 - 24 августа 1832 Теорема Карно: Единственный обратимый процесс
- 37. К.П.Д. цикла Карно Ац = А12 + А23 + А34 + А41 (27)
- 38. КПД тепловой машины, работающей по циклу Карно, не зависит от рода рабочего тела, а зависит только
- 39. 6 учебный вопрос: Энтропия. Второе начало термодинамики. Энтропией называется отношение теплоты, подводимой к термодинамической системе в
- 40. Свойства энтропии 1. В отличие от теплоты, энтропия является функцией состояния, т.е. приращение энтропии не зависит
- 41. Свойства энтропии 2. В ходе необратимого процесса энтропия изолированной системы возрастает: dS>0. 3. Энтропия изолированной системы,
- 42. Теорема Нернста позволяет вычислить энтропию: (30) где c(T) – теплоемкость при заданной температуре
- 43. Второе начало ТД устанавливает направление протекания тепловых процессов. Формулировка немецкого физика Р. Клаузиуса: Невозможен процесс, единственным
- 44. Второе начало ТД – формулировка через энтропию: Все самопроизвольно протекающие процессы в замкнутой системе, приближающие систему
- 45. Энтропия возрастает только в неравновесном процессе. Ее увеличение происходит до тех пор, пока система не достигнет
- 54. Скачать презентацию












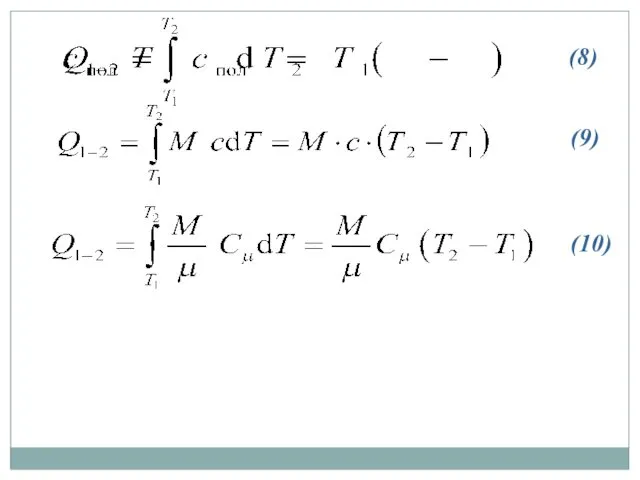


























 Действия электрического тока
Действия электрического тока Аттестационная работа. Методическая разработка проекта по физике на тему «Сила трения и движение»
Аттестационная работа. Методическая разработка проекта по физике на тему «Сила трения и движение» Контроль формы оптических поверхностей пробным стеклом, на интерферометре Физо и на неравноплечем лазерном интерферометре
Контроль формы оптических поверхностей пробным стеклом, на интерферометре Физо и на неравноплечем лазерном интерферометре Гамма-излучение
Гамма-излучение Альберт Эйнштейн
Альберт Эйнштейн Силы в природе
Силы в природе Тормозные системы с пневмоприводом
Тормозные системы с пневмоприводом Атомно-абсорбционная спектрометрия
Атомно-абсорбционная спектрометрия Исследование свойств магнита
Исследование свойств магнита Адсорбация ПАВ на границе раствор - газ
Адсорбация ПАВ на границе раствор - газ Поляризация света. Применение
Поляризация света. Применение Основные понятия и определения в электротехнике
Основные понятия и определения в электротехнике Скорость испарения зависит от рода жидкости. Вода(Жидкость на ватке высохла спустя 2 минуты, ватку сушили феном)
Скорость испарения зависит от рода жидкости. Вода(Жидкость на ватке высохла спустя 2 минуты, ватку сушили феном) Источники электроэнергии
Источники электроэнергии Электрический ток в различных средах. 10 класс
Электрический ток в различных средах. 10 класс Телеграф и перевернутая пирамида
Телеграф и перевернутая пирамида Кинематика точки. Способы задания движения. Уравнения движения. Траектория. Закон движения точки
Кинематика точки. Способы задания движения. Уравнения движения. Траектория. Закон движения точки Презентация Напряжение
Презентация Напряжение Биологиялық жүйелер люминесценциясы. (Дәріс 15)
Биологиялық жүйелер люминесценциясы. (Дәріс 15) Энергияның дәстүрден тыс коздері. Күн энергиясы немесе гелиоэнергетика
Энергияның дәстүрден тыс коздері. Күн энергиясы немесе гелиоэнергетика РЕОСТАТЫ материал к уроку физики в 8 классе учителя МКОУ «Касторенская СОШ №1» Ковтун Аллы Михайловны.
РЕОСТАТЫ материал к уроку физики в 8 классе учителя МКОУ «Касторенская СОШ №1» Ковтун Аллы Михайловны. Презентация по физике Механические колебания
Презентация по физике Механические колебания  Плавление и кристаллизация. Решение задач
Плавление и кристаллизация. Решение задач Физика. Границы применимости
Физика. Границы применимости Жидкостные лазеры
Жидкостные лазеры Министерство Образования и Науки РФ Муниципальное Общеобразовательное Учреждение Аксайская Средняя Общеобразовательная Школа
Министерство Образования и Науки РФ Муниципальное Общеобразовательное Учреждение Аксайская Средняя Общеобразовательная Школа  Решение задач на применение законов Ньютона
Решение задач на применение законов Ньютона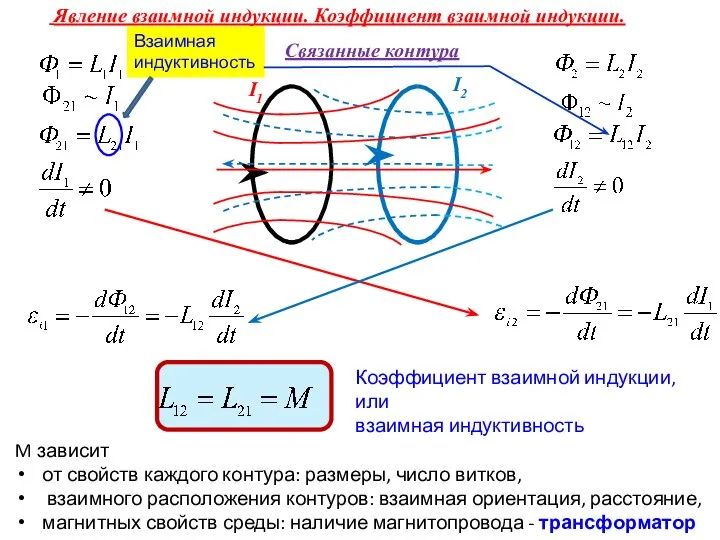 Явление взаимной индукции. Коэффициент взаимной индукции. Взаимная индуктивность
Явление взаимной индукции. Коэффициент взаимной индукции. Взаимная индуктивность