Содержание
- 2. Здесь dN/dt и dq/dt - накопление вещества и теплоты в выделенном элементарном объеме. Nвх и Qвх
- 3. Уравнения составляются для всех участвующих в процессе веществ Для многофазных процессов уравнения составляют для каждой фазы
- 4. Математическая модель процесса в периодическом реакторе идеального смешения (РИС) Все компоненты одновременно загружают в реактор. Реакция
- 5. Процесс – нестационарный dN/dt ≠ 0. В реакторе нет входящих и выходящих потоков ΣNвх = 0.
- 6. Источники тепла – изменение энтальпии в химическом превращении ΣQист = ∑Qpi·ri(С,T)·Vp [для единственной реакции ΣQист =
- 7. Изменение количества теплоты в реакторе dq связано с изменением температуры в нем: dq = cpVpdT (принимаем
- 8. Математическая модель процесса в реакторе идеального вытеснения (РИВ) Режим течения потока через реактор без переме-шивания. Профиль
- 9. где -условное время реакции. Источник вещества в выделенном объеме химическое превращение ΣNистi = Wi (С,
- 10. dq/dt = 0 - процесс стационарен; V0·cpT - тепловой поток, входящий в элементарный объем, и V0·cp(T
- 11. Далее: 0 = V0·cpT - V0·cpT - V0·cpdT + ∑Qpi·ri(С,T)··dVp + Кт·dFт(Тх - Т); V0·cpdT =
- 12. Неизотермический периодический процесс в химическом реакторе идеального смешения и неизотермический непрерывный процесс в химическом реакторе идеального
- 13. А в случае протекания простой реакции W(С,T) =-r(С,T) Перейдя к степени превращения х=(С0 - С)/С0 →
- 14. Выражение адиабатический разогрев. Отношение скорости реакции r(С,Т) к исходной концентрации С0 выразим через степень превращения х
- 16. Скачать презентацию













 История развития электротехники
История развития электротехники Постійні магніти. Магнітне поле Землі. Взаємодія магнітів
Постійні магніти. Магнітне поле Землі. Взаємодія магнітів Обертальний рух тіла. Період та частота обертання
Обертальний рух тіла. Період та частота обертання Расчет пути и времени движения
Расчет пути и времени движения Механизация и автоматизация в строительстве. (Тема 1.3)
Механизация и автоматизация в строительстве. (Тема 1.3) Основные понятия кинематики. Тест №1. 9 класс
Основные понятия кинематики. Тест №1. 9 класс Оптика
Оптика Жылулық сәулелену. Абсолют қара дене
Жылулық сәулелену. Абсолют қара дене Рівноприскорений рух. Прискорення. Рівняння рівноприскореного руху
Рівноприскорений рух. Прискорення. Рівняння рівноприскореного руху Ультразвуковий метод контролю дефектів у матеріалах і виробах
Ультразвуковий метод контролю дефектів у матеріалах і виробах Физика 7 класс - Презентация_
Физика 7 класс - Презентация_ Двигатель автомобиля ЛАДА ЛАРГУС. Механизмы двигателя. Заправка автомобилей ЛАДА топливом
Двигатель автомобиля ЛАДА ЛАРГУС. Механизмы двигателя. Заправка автомобилей ЛАДА топливом Механические колебания и волны. Звук
Механические колебания и волны. Звук Собирающие линзы
Собирающие линзы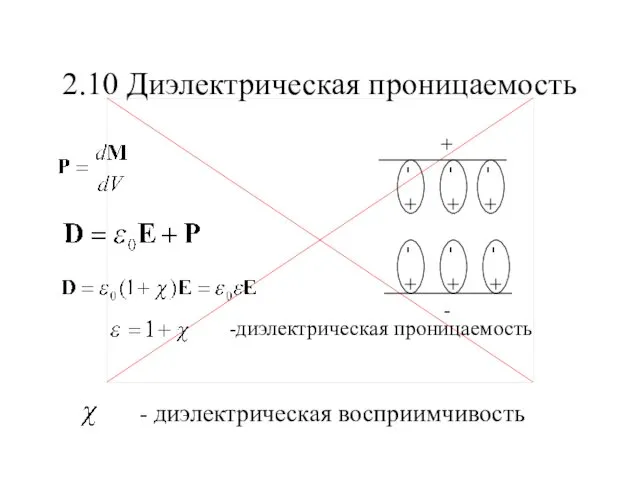 Диэлектрическая проницаемость
Диэлектрическая проницаемость Применение материалов в кабельных изделиях
Применение материалов в кабельных изделиях Презентация по физике. Учащихся 11 «А» Волковой Натальи Гребенниковой Ольги Молючковой Елены
Презентация по физике. Учащихся 11 «А» Волковой Натальи Гребенниковой Ольги Молючковой Елены Виды газовых разрядов и их применение
Виды газовых разрядов и их применение Физика конденсированного состояния. Движение электронов в атоме
Физика конденсированного состояния. Движение электронов в атоме «Волшебный мир магнетизма» Школкина Людмила Александровна Учитель физики МОБУ СОШ № 24 имени С. И. Климакова Г. Якутск
«Волшебный мир магнетизма» Школкина Людмила Александровна Учитель физики МОБУ СОШ № 24 имени С. И. Климакова Г. Якутск Рамы дизелей
Рамы дизелей Свободное падение тел.
Свободное падение тел.  Бойлер косвенного нагрева из нержавеющей стали система бак-в-баке
Бойлер косвенного нагрева из нержавеющей стали система бак-в-баке Фотоны. Эффект Комптона
Фотоны. Эффект Комптона Все о радиации
Все о радиации Динамика материальной точки
Динамика материальной точки Кристалдану үдерісі
Кристалдану үдерісі Робототехника
Робототехника