Содержание
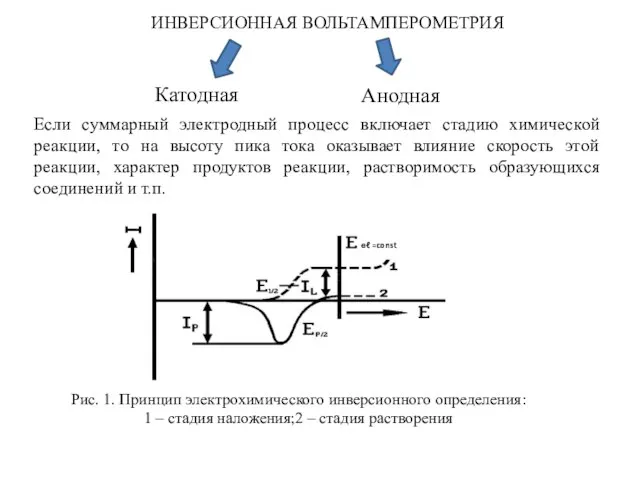
- 2. ИНВЕРСИОННАЯ ВОЛЬТАМПЕРОМЕТРИЯ Катодная Анодная Если суммарный электродный процесс включает стадию химической реакции, то на высоту пика
- 3. Количество осажденного вещества на электроде можно оценить с помощью закона Фарадея где m – масса осажденного
- 4. Для пленочного электрода толщиной ℓ количество вещества в пленке С можно рассчитать по уравнению Для оценки
- 5. Если процесс контролируется скоростью массопереноса; для случая предшествующей химической реакции где k – константа скорости, К
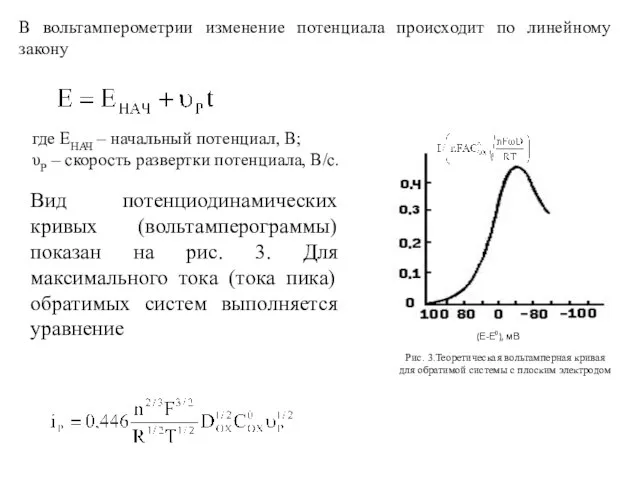
- 6. В вольтамперометрии изменение потенциала происходит по линейному закону где ЕНАЧ – начальный потенциал, В; υР –
- 7. Потенциал максимума (пика) на вольтамперной кривой связан с потенциалом полуволны Е1/2 соотношением Соответственно для потенциала В
- 8. ИНВЕРСИОННАЯ ВОЛЬТАМПЕРОМЕТРИЯ МЫШЬЯКА: ВЛИЯНИЕ ПРИРОДЫ МАТЕРИАЛА КАТОДА Поскольку в ячейке используется катионообменная мембрана, в процессе электролиза
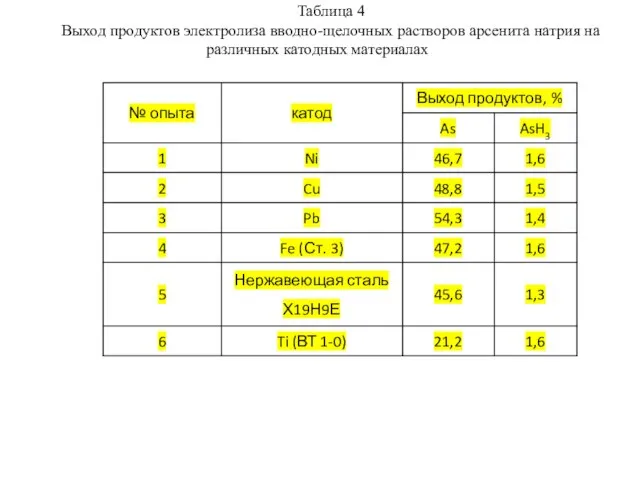
- 9. Таблица 4 Выход продуктов электролиза вводно-щелочных растворов арсенита натрия на различных катодных материалах
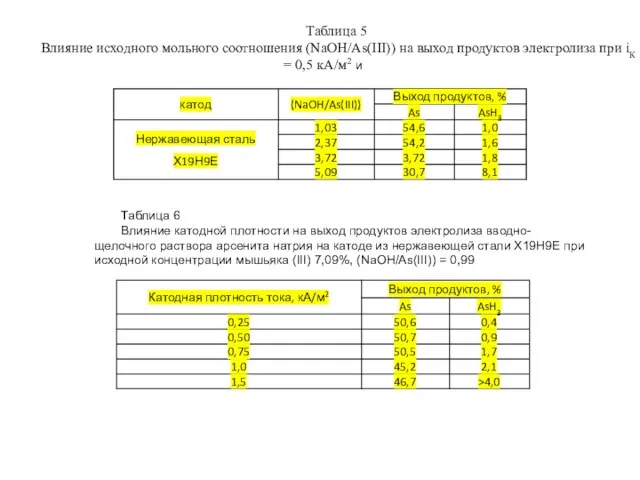
- 10. Таблица 5 Влияние исходного мольного соотношения (NaOH/As(III)) на выход продуктов электролиза при iК = 0,5 кА/м2
- 12. Скачать презентацию





 Интерференция, получаемая делением амплитуды
Интерференция, получаемая делением амплитуды Расчеты на изгиб
Расчеты на изгиб Ғажайып ұяшықтар
Ғажайып ұяшықтар ПИД - регулятор
ПИД - регулятор Поле в диэлектрике
Поле в диэлектрике Бүкіл әлемдік тартылыс заңы
Бүкіл әлемдік тартылыс заңы Постулаты Бора. Модель атома Нильса Бора
Постулаты Бора. Модель атома Нильса Бора Резонанс токов в электрических цепях
Резонанс токов в электрических цепях Презентация по физике "Что такое сила" - скачать
Презентация по физике "Что такое сила" - скачать  Камера Вильсона. Подготовила Корниловская Валерия.
Камера Вильсона. Подготовила Корниловская Валерия. Электроемкость
Электроемкость Математические модели и методы оптимизации процессов пространственного маневрирования морских подвижных объектов
Математические модели и методы оптимизации процессов пространственного маневрирования морских подвижных объектов Тепломассообмен. Нестационарная теплопроводность
Тепломассообмен. Нестационарная теплопроводность Нам не дано предугадать, как эти звуки отзовутся… Петрова Елена 6 «А» класс МОУ «СОШ №11» г. Находка 2007 г.
Нам не дано предугадать, как эти звуки отзовутся… Петрова Елена 6 «А» класс МОУ «СОШ №11» г. Находка 2007 г. Импульсные измерения кубитов
Импульсные измерения кубитов Магнитное поле в веществе
Магнитное поле в веществе Импульс материальной точки, системы материальных точек. Закон сохранения и изменения импульса
Импульс материальной точки, системы материальных точек. Закон сохранения и изменения импульса Презентация по физике "Люмінесценсія" - скачать бесплатно
Презентация по физике "Люмінесценсія" - скачать бесплатно Двухтактный преобразователь постоянного напряжения с трансформаторной развязкой
Двухтактный преобразователь постоянного напряжения с трансформаторной развязкой Швейная машина
Швейная машина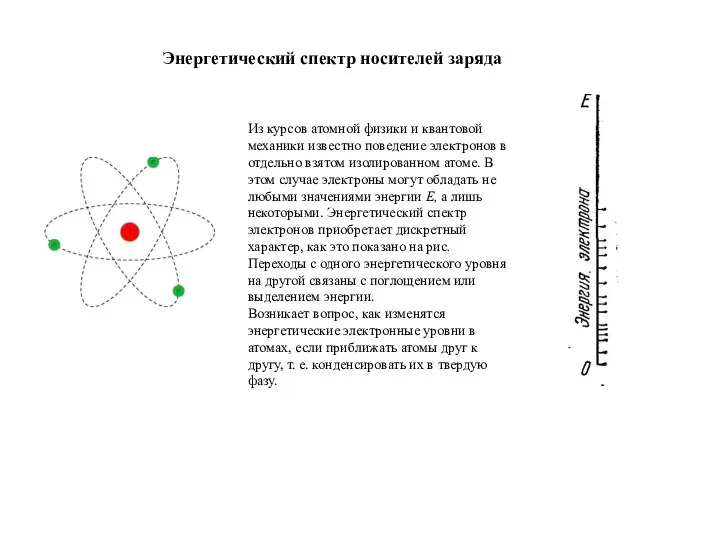 Энергетический спектр носителей заряда. Зонная структура энергетического спектра кристалла
Энергетический спектр носителей заряда. Зонная структура энергетического спектра кристалла Соединение проводников
Соединение проводников Напівпровідникові прилади та їх застосування Проектна робота Учениці 11 класу Дурман Анни
Напівпровідникові прилади та їх застосування Проектна робота Учениці 11 класу Дурман Анни  Одномерные изоэнтропные движения газа
Одномерные изоэнтропные движения газа А. Зайцев, В. Петров, В. Одинцов, В. Шилимов ИЗМИРАН, г. Троицк Московской обл.
А. Зайцев, В. Петров, В. Одинцов, В. Шилимов ИЗМИРАН, г. Троицк Московской обл.  Применение лазерных технологий («лазерный пинцет») для исследования динамики наномашин
Применение лазерных технологий («лазерный пинцет») для исследования динамики наномашин Физика в космосе
Физика в космосе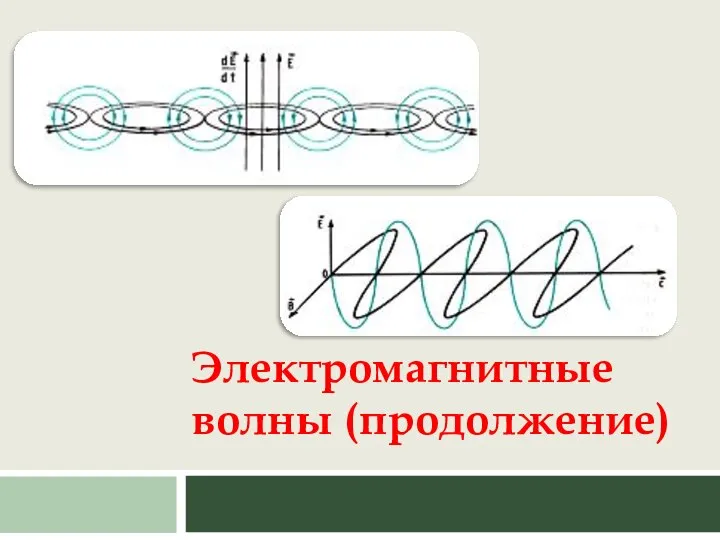 Электромагнитные волны (продолжение)
Электромагнитные волны (продолжение)