Содержание
- 2. ОБОЗНАЧЕНИЕ НАПРАВЛЕНИЙ В КРИСТАЛЛЕ В кристаллографии возникает необходимость в определении направления отдельных атомных рядов; или атомных
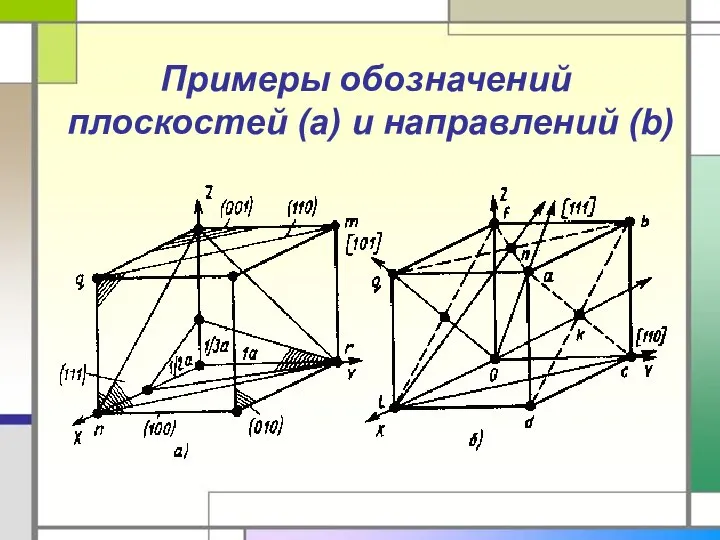
- 3. [u, v, w] = [х0 /r, у0 /r, z0 /r] Ось +x соответствует направлению [1,0,0]; ось
- 4. Примеры обозначений плоскостей (a) и направлений (b)
- 5. ОБОЗНАЧЕНИЕ ПЛОСКОСТЕЙ В КРИСТАЛЛЕ Набор параллельных атомных плоскостей можно охарактеризовать также с помощь трех чисел –
- 6. ( h, k, l ) = ( s/х1 , s/y1 , s/z1 ) Остальные правила для
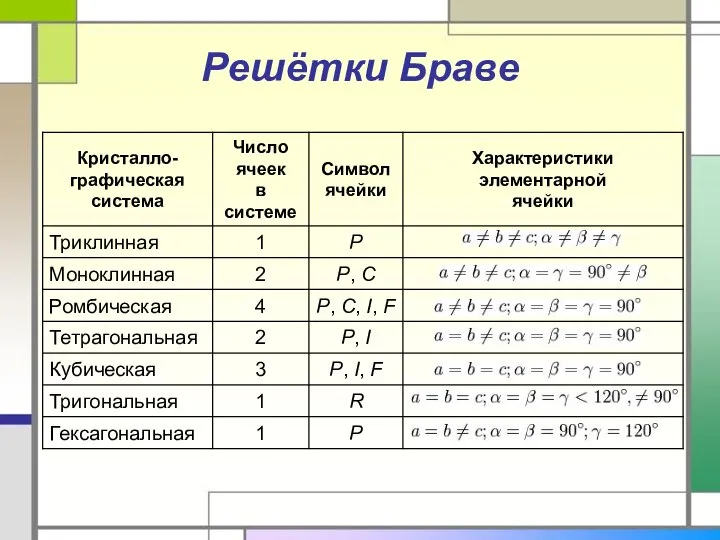
- 7. Классификация решеток Элементарная ячейка кристалла строится на трёх некомпланарных основных векторах. В зависимости от соотношения между
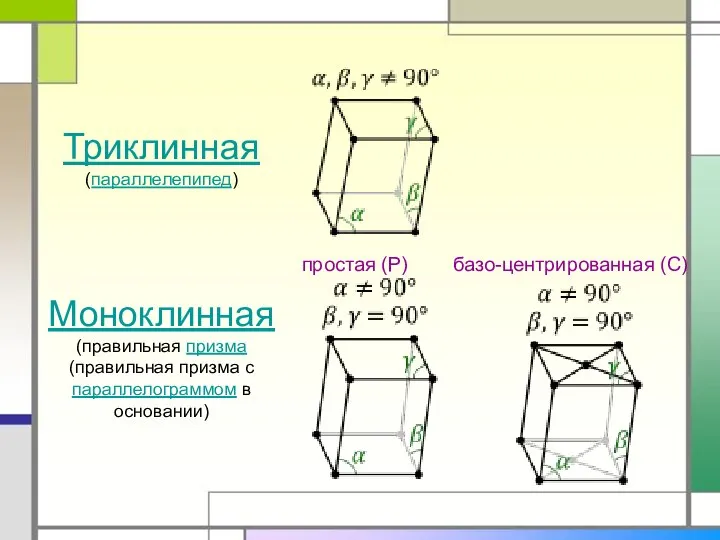
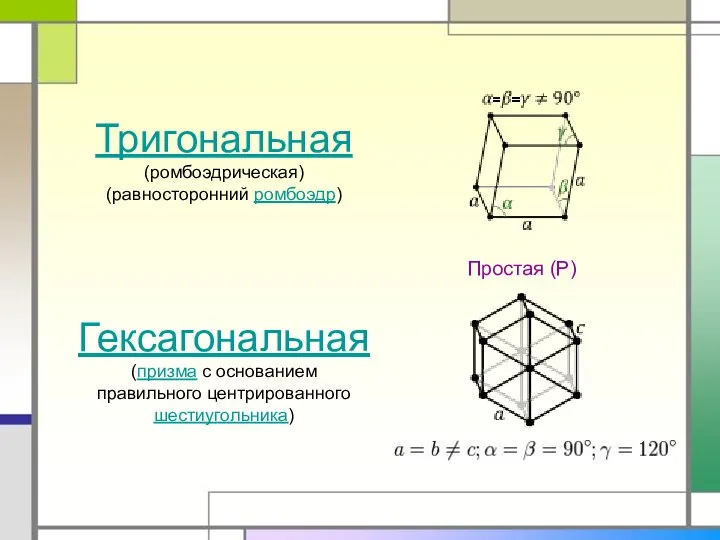
- 8. Решётки Браве
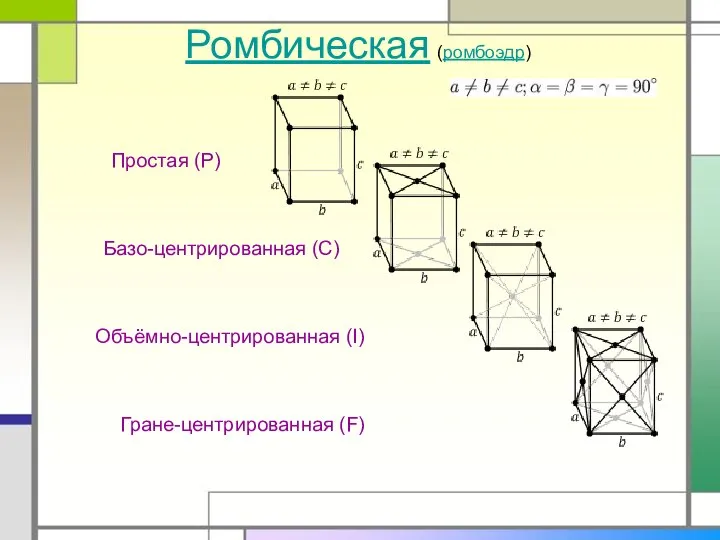
- 10. Ромбическая (ромбоэдр)
- 11. Тетрагональная (прямой параллелепипед)
- 12. Простая (P)
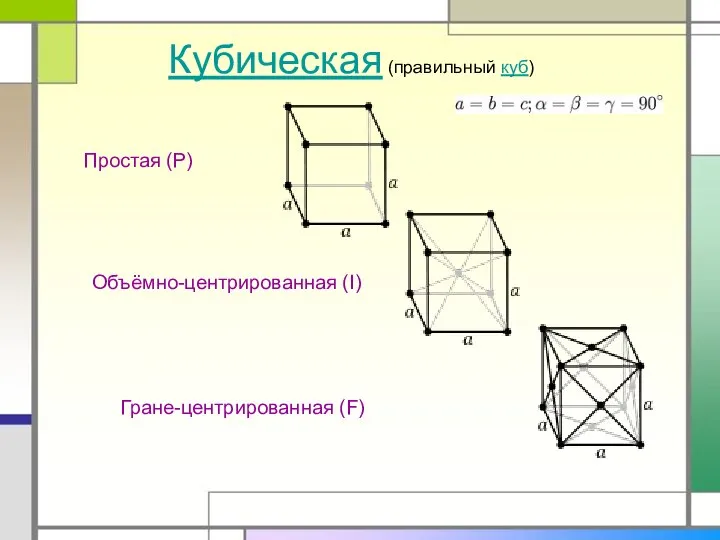
- 13. Кубическая (правильный куб)
- 14. МЕЖАТОМНЫЕ СВЯЗИ Эти два факта дают основание считать, что: электронное строение свободных атомов (прежде всего, строение
- 16. МЕЖАТОМНЫЕ СВЯЗИ
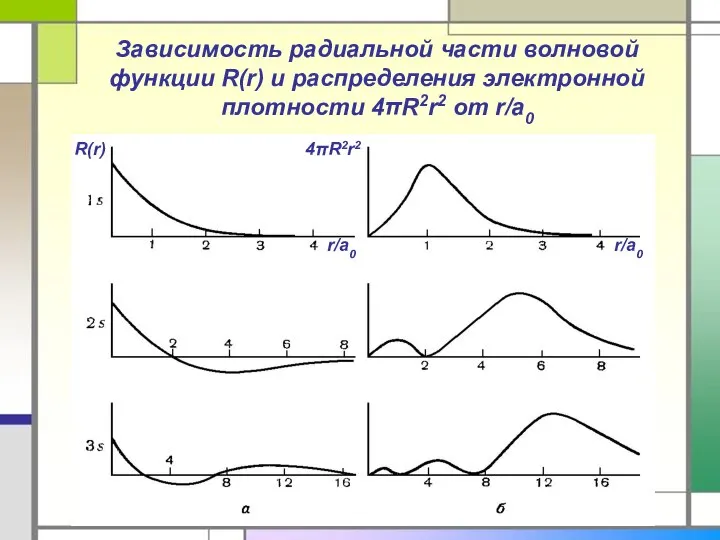
- 17. Зависимость радиальной части волновой функции R(r) и распределения электронной плотности 4πR2r2 от r/a0 R(r) 4πR2r2 r/a0
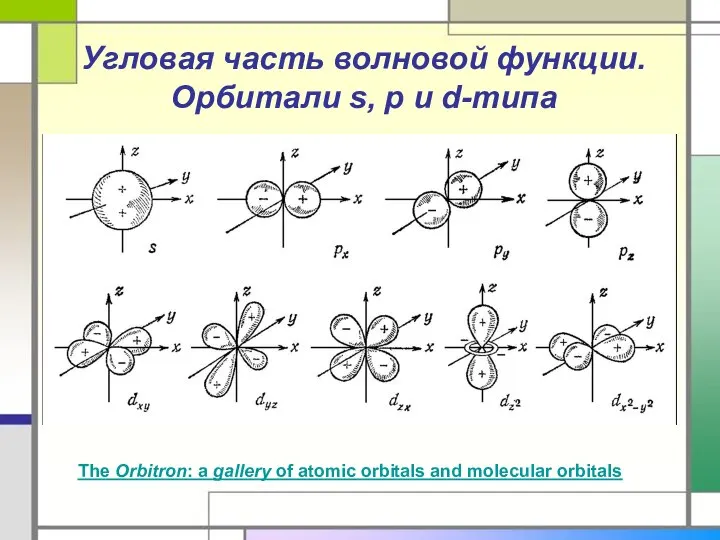
- 18. Угловая часть волновой функции. Орбитали s, p и d-типа The Orbitron: a gallery of atomic orbitals
- 19. Многоэлектронные атомы
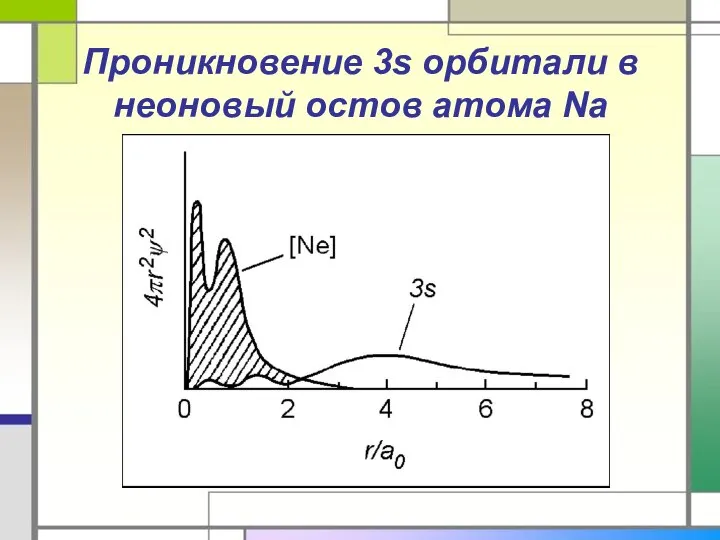
- 21. Проникновение 3s орбитали в неоновый остов атома Na
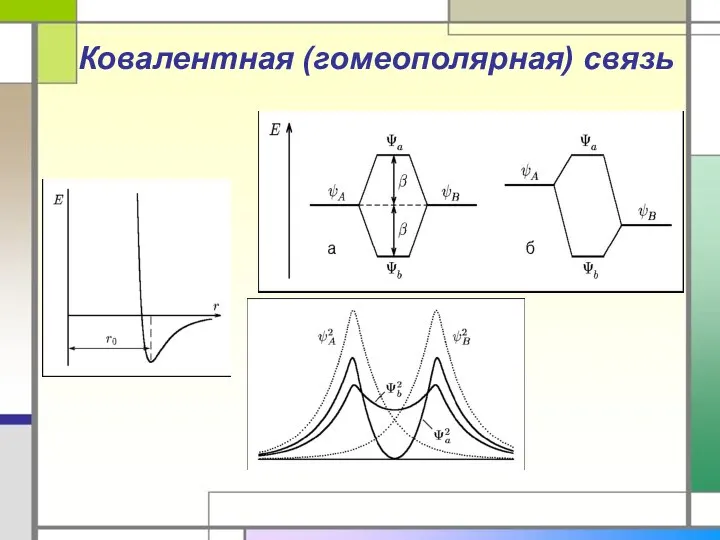
- 22. Ковалентная (гомеополярная) связь Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной. Эта связь обусловлена силами
- 23. Ковалентная (гомеополярная) связь
- 24. Образование молекулярных σ - орбиталей Orbitron
- 25. Молекулярная π -орбиталь Orbitron
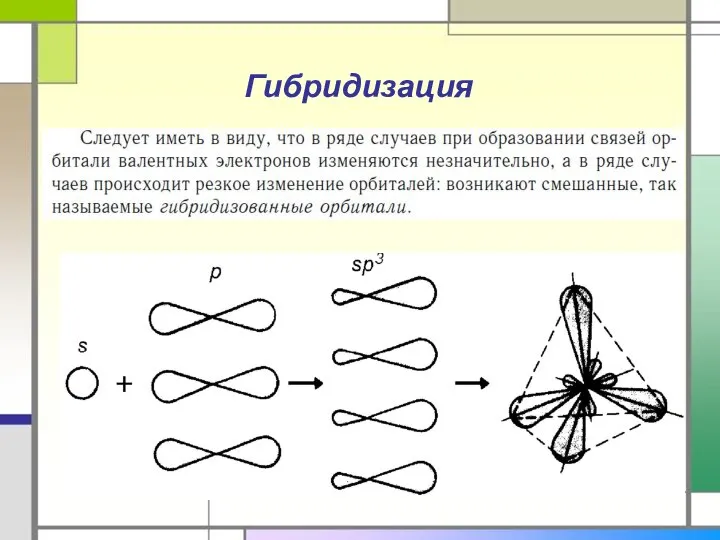
- 26. Гибридизация
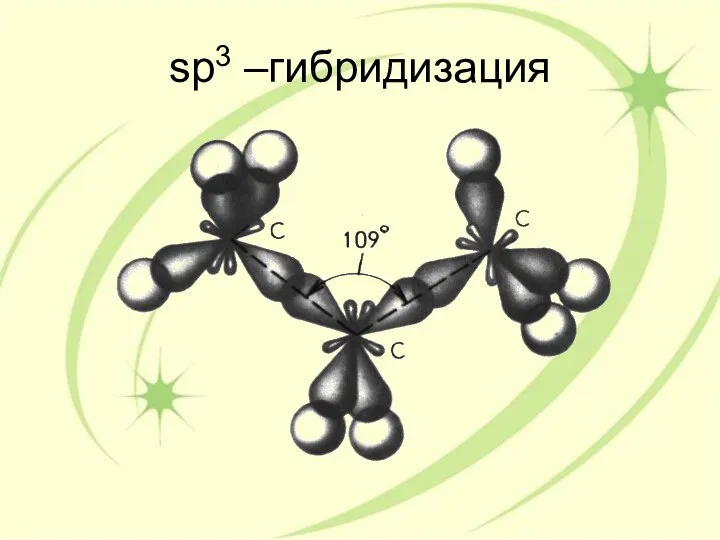
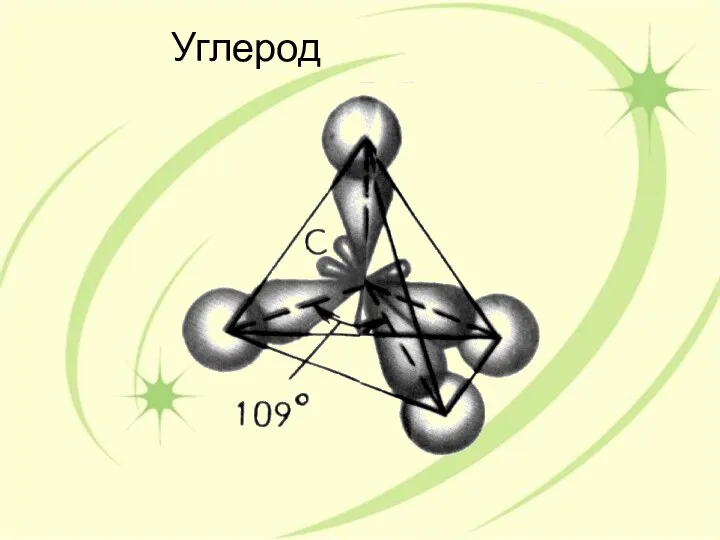
- 27. sp3 –гибридизация
- 28. Углерод
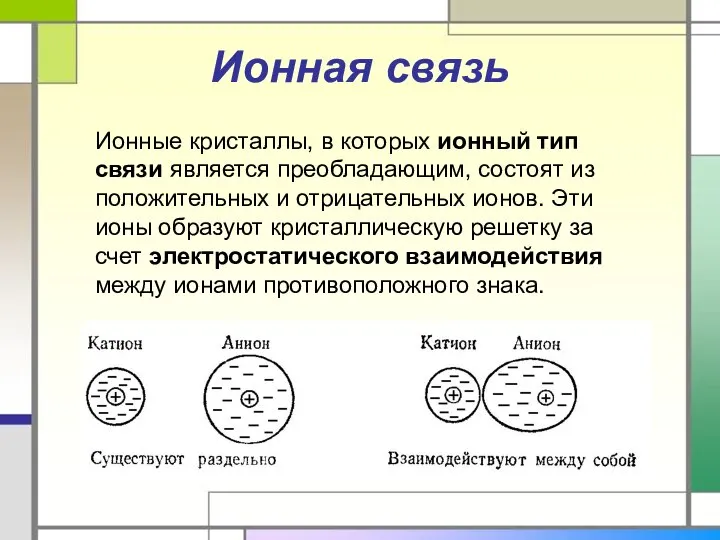
- 30. Ионная связь Ионные кристаллы, в которых ионный тип связи является преобладающим, состоят из положительных и отрицательных
- 31. Ионная связь Электронные оболочки ионов в простом ионном кристалле похожи на электронные оболочки, характерные для атомов
- 32. Молекулярная связь
- 33. Молекулярная связь
- 34. Водородная связь
- 36. Скачать презентацию

![[u, v, w] = [х0 /r, у0 /r, z0 /r] Ось](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1480150/slide-2.jpg)

















 Электромагниттік толқындар. Инфрақызыл сәулелер. Жылу инфрақызыл түсірістер
Электромагниттік толқындар. Инфрақызыл сәулелер. Жылу инфрақызыл түсірістер 173be9b1-e111-46fe-bff2-723e345dacb2
173be9b1-e111-46fe-bff2-723e345dacb2 Геофизические исследования скважин
Геофизические исследования скважин Електричні кола. Послідовне і паралельне з'єднання провідників
Електричні кола. Послідовне і паралельне з'єднання провідників Реактивные самолёты
Реактивные самолёты Теория упругости сплошных сред. Упругие поля (поля напряжений) вокруг дислокаций. Энергия дислокаций
Теория упругости сплошных сред. Упругие поля (поля напряжений) вокруг дислокаций. Энергия дислокаций Презентация по физике "Электромагнитные колебания" - скачать __
Презентация по физике "Электромагнитные колебания" - скачать __ Урок физики в 7 классе на тему : «Единицы силы. Связь между силой тяжести и массой тела» Природа так обо всём позаботилась, что повсю
Урок физики в 7 классе на тему : «Единицы силы. Связь между силой тяжести и массой тела» Природа так обо всём позаботилась, что повсю Способы изменения внутренней энергии тела
Способы изменения внутренней энергии тела Выходные устройства авиационных двигателей. (Тема 7)
Выходные устройства авиационных двигателей. (Тема 7) Физика. Экзамен
Физика. Экзамен Ускорение. Единица ускорения
Ускорение. Единица ускорения Презентация по физике "Транзисторы" - скачать бесплатно
Презентация по физике "Транзисторы" - скачать бесплатно Статические элементы оптоэлектронных систем
Статические элементы оптоэлектронных систем Сплошная среда
Сплошная среда Знакомство с радиопередающем устройством
Знакомство с радиопередающем устройством Напряженное состояние в грунтах. (Лекция 5)
Напряженное состояние в грунтах. (Лекция 5) Роботизированные машины для выполнения интеллектуальных технологий в растениеводстве
Роботизированные машины для выполнения интеллектуальных технологий в растениеводстве Спин. Спиновое взаимодействие
Спин. Спиновое взаимодействие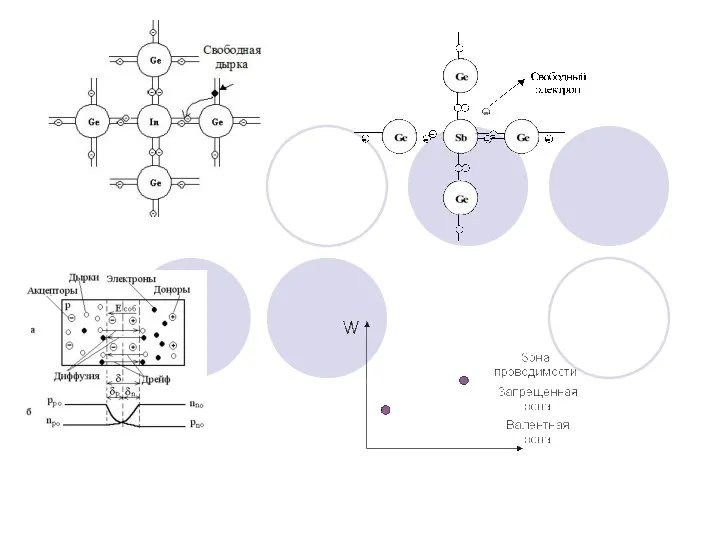 Физические основы полупроводниковых приборов
Физические основы полупроводниковых приборов Движение заряженных частиц в магнитном поле. Сила Лоренца
Движение заряженных частиц в магнитном поле. Сила Лоренца Второй закон термодинамики. Обратимые и необратимые процессы. Энтропия
Второй закон термодинамики. Обратимые и необратимые процессы. Энтропия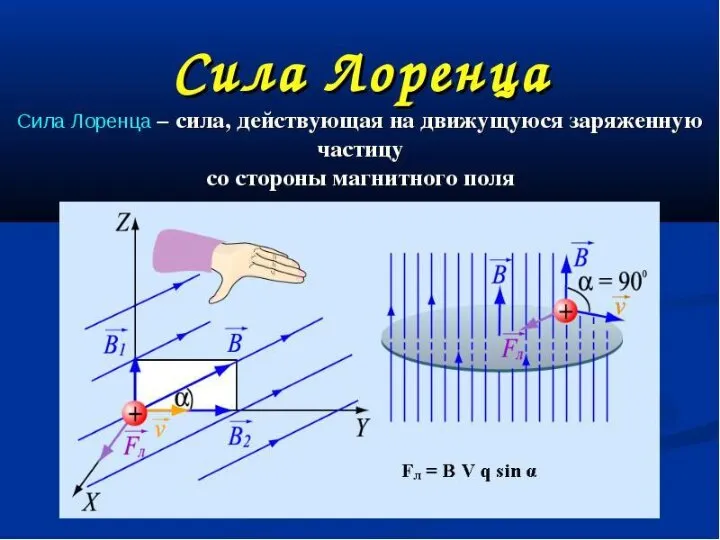 Сила Лоренца. Модуль силы Лоренца
Сила Лоренца. Модуль силы Лоренца Сила трения и СТО. (Лекция 4)
Сила трения и СТО. (Лекция 4) Установка дополнительного уплотнения разъема на аккумуляторную батарею. Инструкция
Установка дополнительного уплотнения разъема на аккумуляторную батарею. Инструкция Спектральный анализ. История открытия и современность
Спектральный анализ. История открытия и современность Профессиональная направленность физики при подготовке обучающихся по профессии «Помощник машиниста локомотива»
Профессиональная направленность физики при подготовке обучающихся по профессии «Помощник машиниста локомотива» Основы термодинамики
Основы термодинамики