Содержание
- 2. 18 апреля 2017 г. БАЗ РХТУ
- 3. 18 апреля 2017 г. БАЗ РХТУ
- 4. 18 апреля 2017 г. БАЗ РХТУ
- 5. МИКРОВОЛНОВАЯ ХИМИЯ-1 Диэлектрические характеристики и поглощение микроволновой энергии веществом.
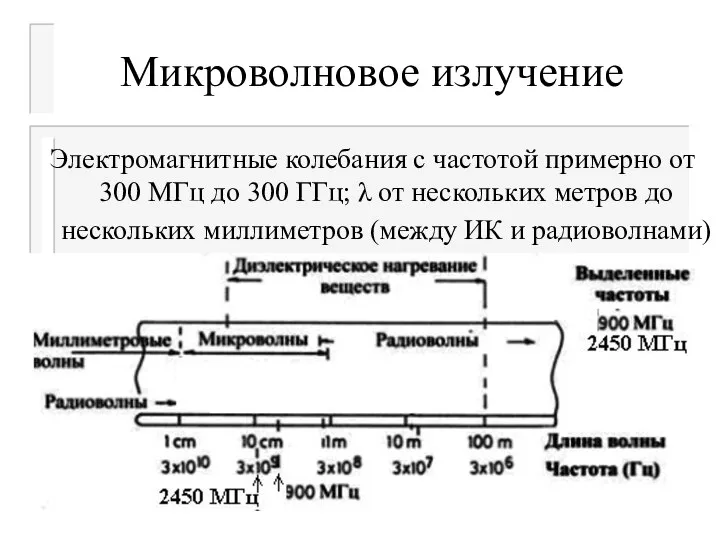
- 6. Микроволновое излучение Электромагнитные колебания с частотой примерно от 300 МГц до 300 ГГц; λ от нескольких
- 7. Микроволновое излучение Не является ионизирующим. Следовательно, не может привести к ионизации атома, поскольку энергия кванта микроволнового
- 8. Микроволновое излучение Для использования электромагнитного излучения в промышленной и быту были регламентированы, в частности, следующие частоты:
- 9. Три группы материалов 1. Металлы – гладкая поверхность полностью отражает микроволны 2. Диэлектрики без потерь –
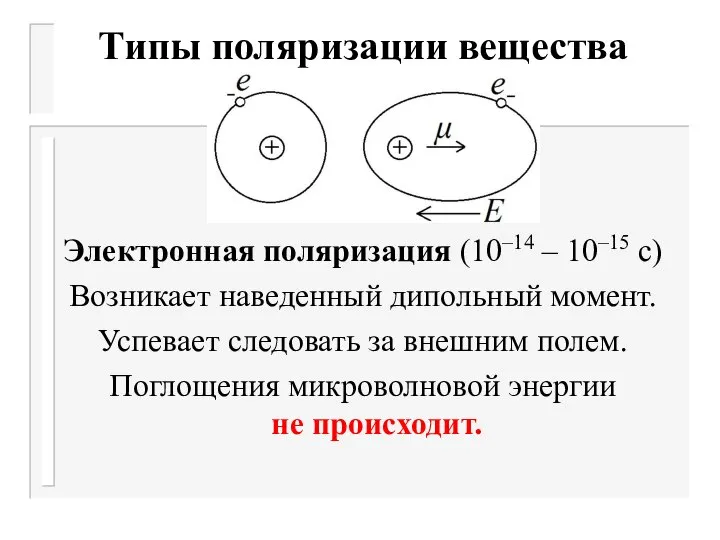
- 10. Типы поляризации вещества Электронная поляризация (10–14 – 10–15 с) Возникает наведенный дипольный момент. Успевает следовать за
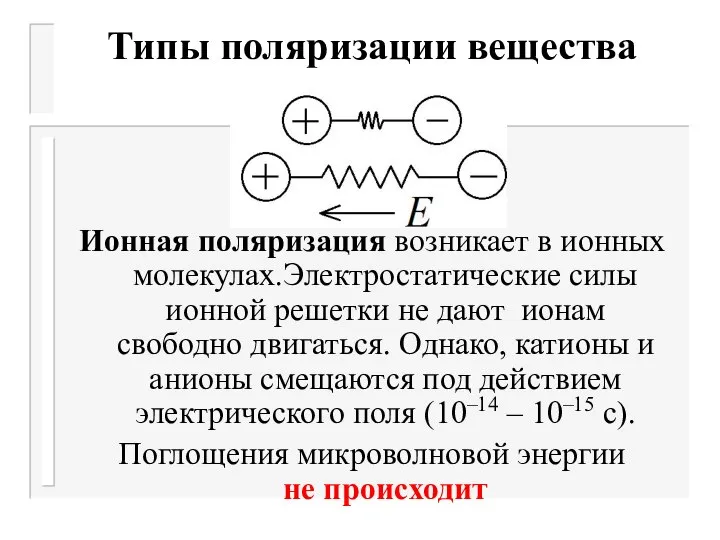
- 11. Типы поляризации вещества Ионная поляризация возникает в ионных молекулах.Электростатические силы ионной решетки не дают ионам свободно
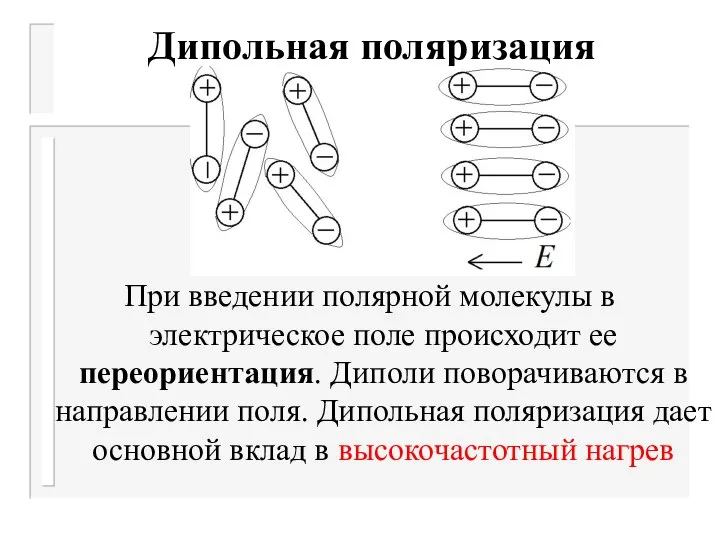
- 12. Дипольная поляризация При введении полярной молекулы в электрическое поле происходит ее переориентация. Диполи поворачиваются в направлении
- 13. Дипольная поляризация В случае дипольной поляризации (10–10 – 10–12 с) перемещение частиц осуществляется с трением, на
- 14. Дипольная поляризация На частоте 2450 МГц переориентация и последующее разупорядочение диполей происходят несколько миллиардов раз за
- 15. Основные электромагнитные характеристики вещества Электрическая проводимость κ – удельная электропроводность (ЭП), [См/м]; 1 сименс=1/Ом κ* =
- 16. Основные электромагнитные характеристики вещества Диэлектрическая проницаемость ε–относительная диэлектрическая проницаемость (ДП); εо = 8,854·10–12 Ф/м – ДП
- 17. Диэлектрическая проницаемость Относительная диэлектрическая проницаемость (ДП) вещества показывает во сколько раз сила взаимодействия между двумя зарядами
- 18. Диэлектрическая проницаемость ДП газов близка к 1 (ε воздуха = 1,0006); твердых веществ 5 – 10
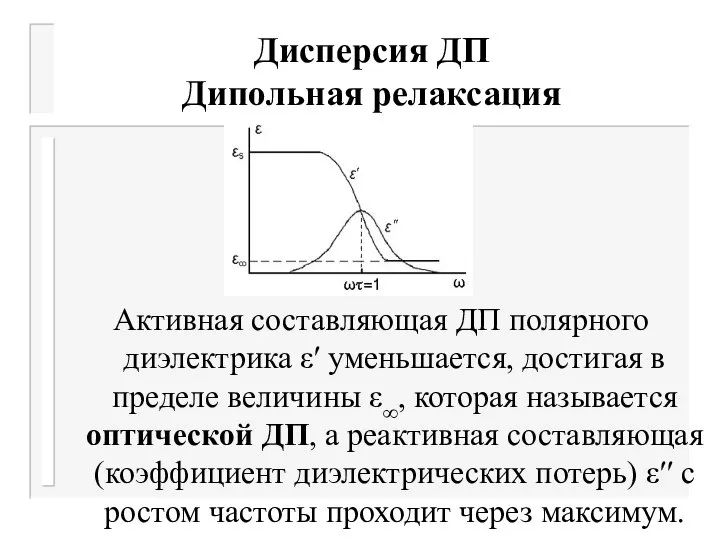
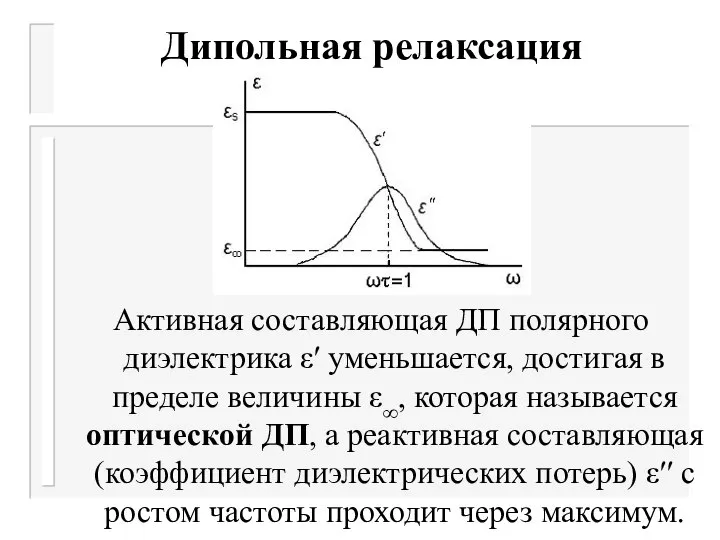
- 19. Дисперсия ДП Дипольная релаксация Поляризация диэлектрика в переменном электрическом поле зависит от частоты. Частотная зависимость электромагнитных
- 20. Дисперсия ДП Дипольная релаксация При низких частотах электромагнитного поля ДП полярного растворителя сохраняет свое постоянное значение
- 21. Дисперсия ДП Дипольная релаксация Активная составляющая ДП полярного диэлектрика ε′ уменьшается, достигая в пределе величины ε∞,
- 22. Дисперсия ДП Дипольная релаксация Для воды при 25 оС εs = 78,3; ε∞=5,0. Для спиртов εs
- 23. Дисперсия ДП Дипольная релаксация Область частот, в которой происходит диэлектрическая релаксация (дисперсия ДП) 0,1 Вода: τ=8,3*10–12.
- 24. Дипольная релаксация Активная составляющая ДП полярного диэлектрика ε′ уменьшается, достигая в пределе величины ε∞, которая называется
- 25. Теория дисперсии ДП Дебая Зависимость ДП от частоты полярных диэлектриков описал П. Дебай: , в уравнениях
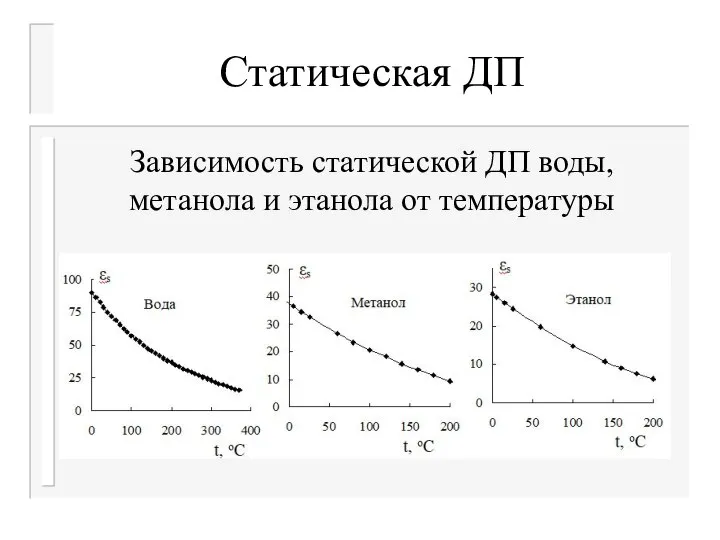
- 26. Статическая ДП При низких частотах ωτ При повышении температуры происходит уменьшение в результате разрушения структуры растворителя
- 27. Статическая ДП Диэлектрическая проницаемость вещества εs зависит от его природы, температуры, а в растворах также от
- 28. Статическая ДП Зависимость статической ДП воды, метанола и этанола от температуры
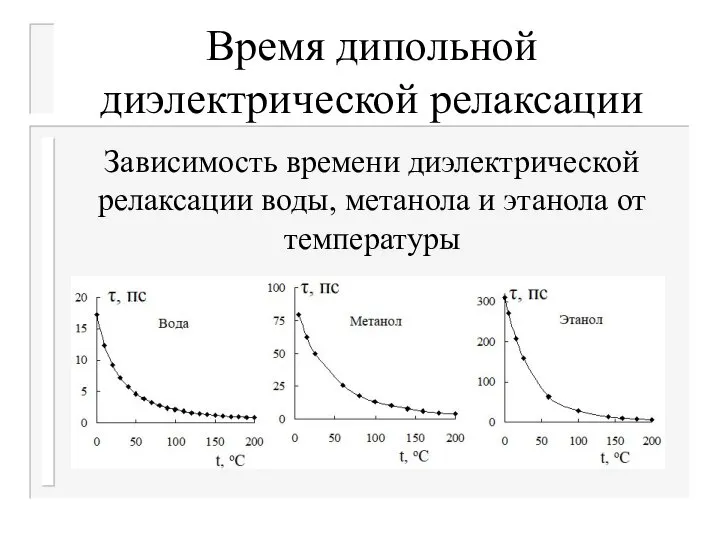
- 29. Время дипольной диэлектрической релаксации Если ДП полярного растворителя можно условно назвать структурной его характеристикой, то время
- 30. Время дипольной диэлектрической релаксации Характеризует подвижность молекул растворителя. Скорость релаксации V=1/τ . При повышении температуры уменьшается
- 31. Время дипольной диэлектрической релаксации Зависимость времени диэлектрической релаксации воды, метанола и этанола от температуры
- 32. Диэлектрические потери Максимум коэффициента диэлектрических потерь ε′′ имеет место при условии ωτ = 1, т.е. когда
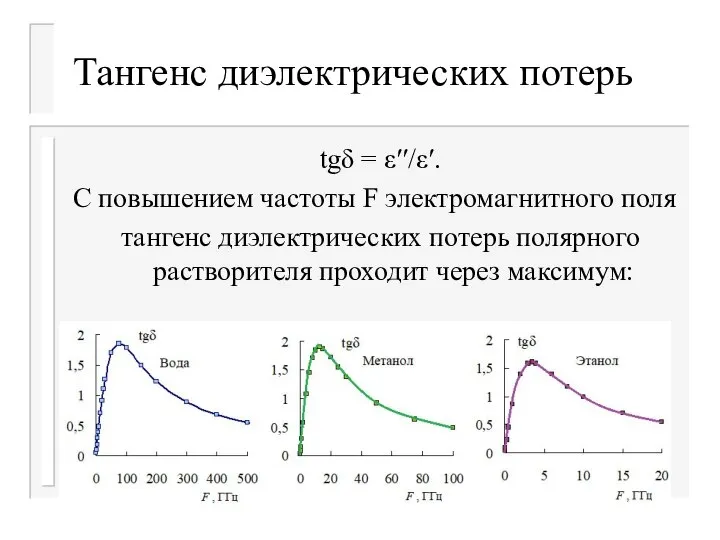
- 33. Тангенс диэлектрических потерь tgδ = ε′′/ε′. С повышением частоты F электромагнитного поля тангенс диэлектрических потерь полярного
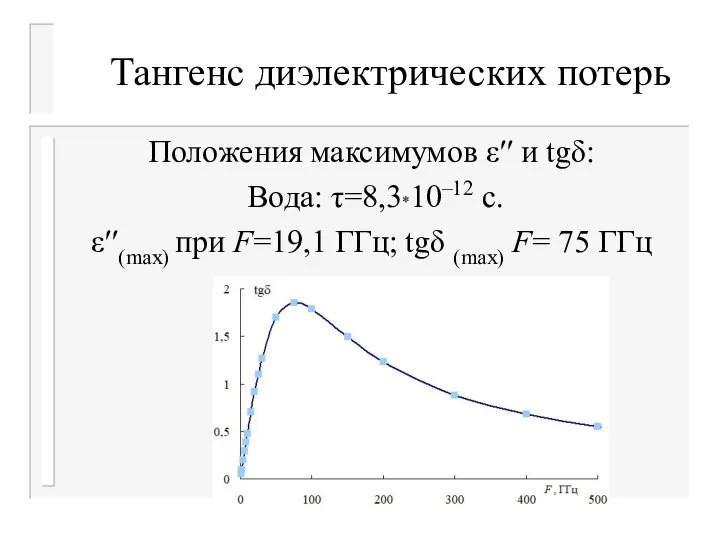
- 34. Тангенс диэлектрических потерь Положения максимумов ε′′ и tgδ: Вода: τ=8,3*10–12 с. ε′′(max) при F=19,1 ГГц; tgδ
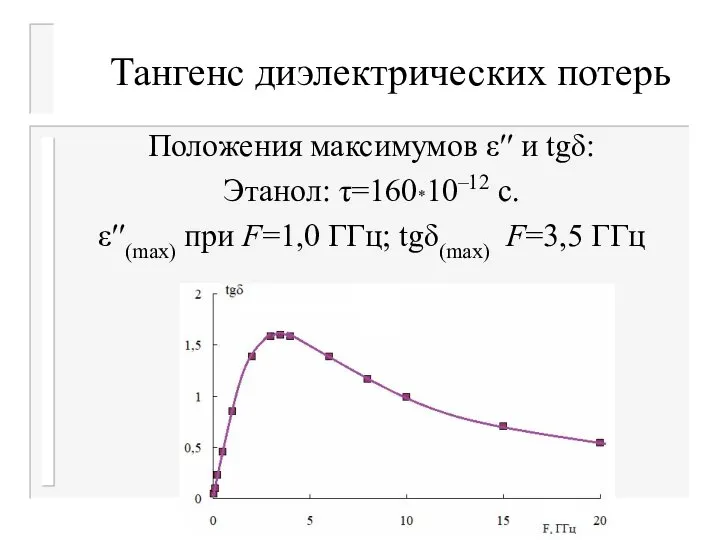
- 35. Тангенс диэлектрических потерь Положения максимумов ε′′ и tgδ: Этанол: τ=160*10–12 с. ε′′(max) при F=1,0 ГГц; tgδ(max)
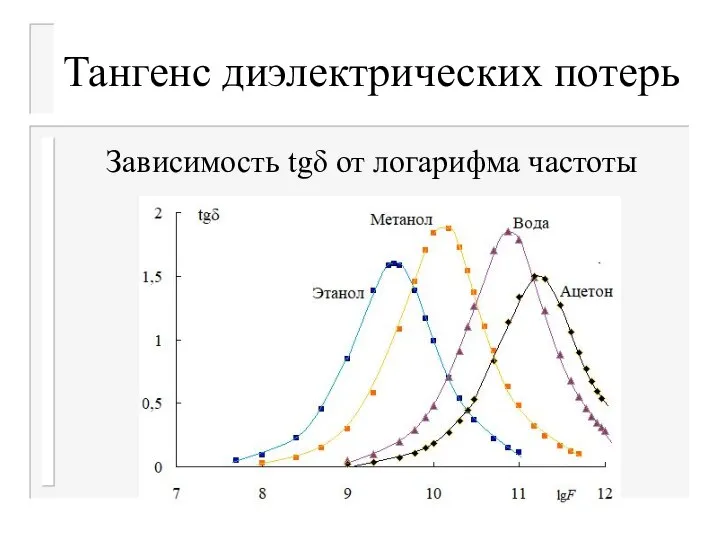
- 36. Тангенс диэлектрических потерь Зависимость tgδ от логарифма частоты
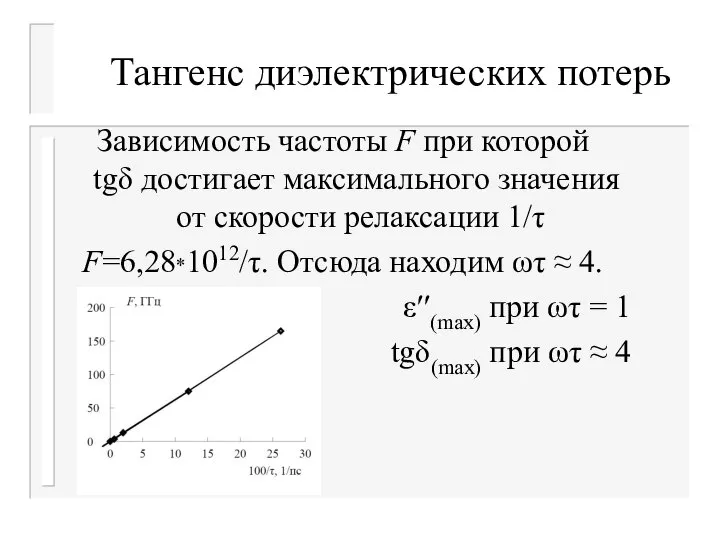
- 37. Тангенс диэлектрических потерь Зависимость частоты F при которой tgδ достигает максимального значения от скорости релаксации 1/τ
- 38. Круговая диаграмма дипольной диэлектрической релаксации Описываемая уравнениями Дебая дисперсия может быть также представлена в виде круговых
- 39. Диаграмма Коула представляет собой полуокружность с радиусом (εs-ε∞)/2 и с центром на оси абсцисс на расстоянии
- 40. Расчет по уравнениям Дебая Используя уравнения Дебая рассчитаем активную и реактивную составляющие комплексной ДП воды и
- 41. Расчет по уравнениям Дебая; F=2450 МГц (λ=12,2 см) Вода. εs=78,3; τ = 8,3·10-12 с ω=6,28·2450·106=1,54·1010 .
- 42. Расчет по уравнениям Дебая Метанол. εs=32,6; τ = 50,2·10-12 с ωτ=1,54·1010 ·50,2·10-12 =0,774. (ωτ)2=0,60. ε′=5 +
- 43. Глубина проникновения СВЧ излучения в вещество Глубина проникновения СВЧ электромагнитного поля в объем вещества зависит от
- 44. Глубина проникновения СВЧ излучения в вещество В проводящих средах κ = ωεоε" . Глубина проникновения СВЧ
- 45. Глубина проникновения СВЧ Глубина проникновения микроволнового излучения в раствор обратно пропорциональна удельной ЭП. Таким образом, чем
- 46. Глубина проникновения СВЧ Варьируя параметрами СВЧ поля (F, Е) и удельными характеристиками раствора (ε, κ) можно
- 47. Глубина проникновения СВЧ Обычно для микроволнового нагрева используют смеси веществ, которые слабо и сильно поглощают МВ-излучение;
- 48. Расчетные задачи по микроволновой химии-1 1. Статическая диэлектрическая проницаемость εs метанола равна 32,6, а время диэлектрической
- 49. Расчетные задачи по микроволновой химии-1 Решение Коэффициент диэлектрических потерь ε″ достигает максимума при условии ωτ =
- 50. Расчетные задачи по микроволновой химии-1 2. Определить время релаксации раствора, для которого в бытовой СВЧ-печи коэффициент
- 51. Расчетные задачи по микроволновой химии Решение. Коэффициент диэлектрических потерь ε″ достигает максимума при условии ωτ =
- 52. Расчетные задачи по микроволновой химии 3. При температуре 15 оС статическая ДП εs метанола равна 34,5,
- 53. Расчетные задачи по микроволновой химии Решение.
- 54. Расчетные задачи по микроволновой химии Решение ωτ=6,28·2450·106·62,5·10-12=0,962 (ωτ)2=0,925 ε' = 2,0 + (34,5–2,0)/(1+0,925)=18,9. ε'' = [(34,5–2,0)/(1+0,925)]·0,962=16,2.
- 55. Расчетные задачи по микроволновой химии 4. При температуре 25 оС статические диэлектрические проницаемости εs пропанола и
- 56. Расчетные задачи по микроволновой химии Решение Поглощаемая мощность СВЧ Р = ωεоε'' Е2 = κ′ Е2.
- 57. Расчетные задачи по микроволновой химии Решение Для пропанола: ωτ=6,28·915·106·320·10-12=1,84. (ωτ)2=3,38. ε'' = [(20,5–2,0)/(1+3,38)]·1,84=7,77
- 59. Скачать презентацию







































![Расчетные задачи по микроволновой химии Решение ωτ=6,28·2450·106·62,5·10-12=0,962 (ωτ)2=0,925 ε' = 2,0 + (34,5–2,0)/(1+0,925)=18,9. ε'' = [(34,5–2,0)/(1+0,925)]·0,962=16,2.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/722632/slide-53.jpg)


![Расчетные задачи по микроволновой химии Решение Для пропанола: ωτ=6,28·915·106·320·10-12=1,84. (ωτ)2=3,38. ε'' = [(20,5–2,0)/(1+3,38)]·1,84=7,77](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/722632/slide-56.jpg)
 Системы автоматического управления (САУ). Теория автоматического управления (ТАУ)
Системы автоматического управления (САУ). Теория автоматического управления (ТАУ) ОКРУЖНОЙ НАУЧНО-ПРАКТИЧЕСКИЙ СЕМИНАР ЛИЧНОСТНО ОРИЕНТИРОВАННОЕ ОБУЧЕНИЕ 7класс урок физики по теме: учитель высше
ОКРУЖНОЙ НАУЧНО-ПРАКТИЧЕСКИЙ СЕМИНАР ЛИЧНОСТНО ОРИЕНТИРОВАННОЕ ОБУЧЕНИЕ 7класс урок физики по теме: учитель высше Презентация по физике Скорость света
Презентация по физике Скорость света  Галилео Галилей
Галилео Галилей Розробка математичної моделі фазованої антенної решітки СВЦ 9С18М1
Розробка математичної моделі фазованої антенної решітки СВЦ 9С18М1 Сообщающиеся сосуды
Сообщающиеся сосуды Основы хроматографического анализа
Основы хроматографического анализа Биомеханические принципы в технике Носова Дарья, ученица 10 А класса МОУ «Средняя общеобразовательная школа» №57 г. Курска
Биомеханические принципы в технике Носова Дарья, ученица 10 А класса МОУ «Средняя общеобразовательная школа» №57 г. Курска Передачи винт- гайка
Передачи винт- гайка Звуки
Звуки  Оптические методы анализа
Оптические методы анализа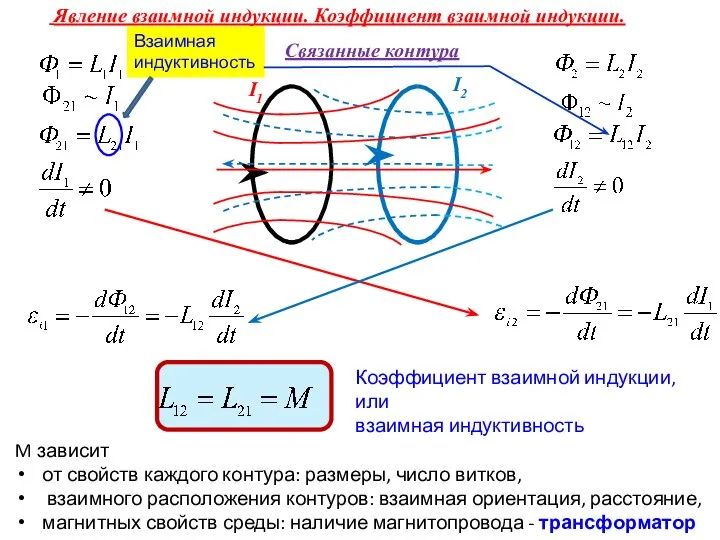 Явление взаимной индукции. Коэффициент взаимной индукции. Взаимная индуктивность
Явление взаимной индукции. Коэффициент взаимной индукции. Взаимная индуктивность Механическое движение
Механическое движение Автоколебания. Трансформатор
Автоколебания. Трансформатор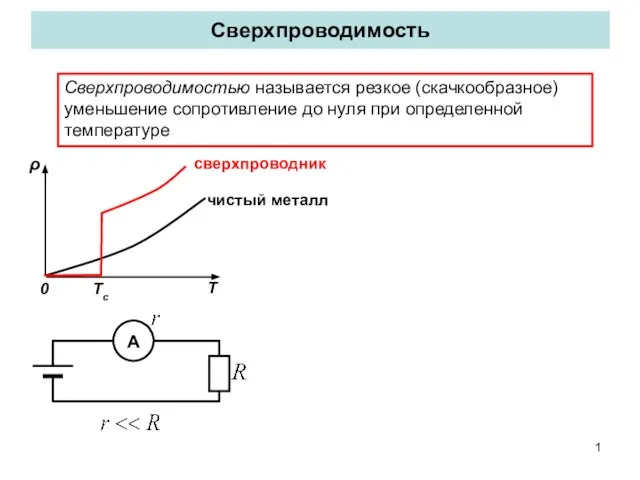 Сверхпроводимость. Криопроводники
Сверхпроводимость. Криопроводники Линейные электрические цепи постоянного тока
Линейные электрические цепи постоянного тока Физика - первые шаги (3 класс)
Физика - первые шаги (3 класс) Энергия топлива
Энергия топлива Презентация по физике "Определение поверхностного натяжения" - скачать
Презентация по физике "Определение поверхностного натяжения" - скачать  Высокоэнергетические материалы в системах детонационной автоматики аэрокосмических аппаратов
Высокоэнергетические материалы в системах детонационной автоматики аэрокосмических аппаратов Эквивалентные преобразования схем
Эквивалентные преобразования схем Механическая работа. Единицы работы. Мощность. Единицы мощности
Механическая работа. Единицы работы. Мощность. Единицы мощности Наша группа работала над вопросом
Наша группа работала над вопросом Функциональная схема скоростной САР
Функциональная схема скоростной САР Строение атома. Урок №7
Строение атома. Урок №7 Передача электрической энергии на расстояние
Передача электрической энергии на расстояние Тепловые машины. (8 класс)
Тепловые машины. (8 класс) Электротехника и электроника. Электрические цепи постоянного тока. (Лекция 1)
Электротехника и электроника. Электрические цепи постоянного тока. (Лекция 1)