Содержание
- 2. Общая характеристика метода Хроматография – это физический метод разделения веществ, в котором разделяемые компоненты распределяются между
- 3. Общая характеристика метода Хроматография основана на прохождении разделяемых компонентов через систему подвижной и неподвижной фаз. Анализируемую
- 4. Общая характеристика метода На величину константы распределения влияют температура, природа неподвижной и подвижной фаз. Вещества с
- 5. Общая характеристика метода 1903 год – русский ученый М.С. Цвет сообщил о разделении окрашенных компонентов экстрактов
- 6. Общая характеристика метода Хроматография используется для: разделения многокомпонентных смесей; очистки веществ от примесей; оценки однородности веществ;
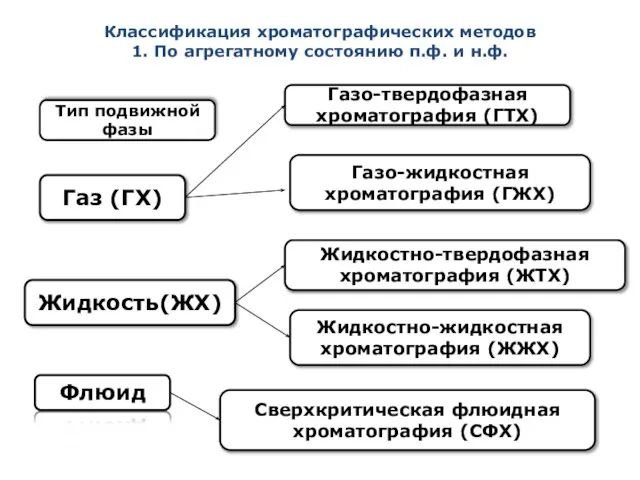
- 7. Тип подвижной фазы Газ (ГХ) Жидкость(ЖХ) Флюид Газо-твердофазная хроматография (ГТХ) Газо-жидкостная хроматография (ГЖХ) Жидкостно-твердофазная хроматография (ЖТХ)
- 8. 1.2 По механизму разделения (по типу устанавливающихся равновесий)
- 9. 1.3 По технике эксперимента Колоночная (капиллярная) хроматография Плоскостная хроматография (ТСХ, бумажная)
- 10. 1.4 По цели хроматографирования Аналитическая хроматография – качественный, количественный, молекулярно- структурный анализ Препаративная хроматография – выделение
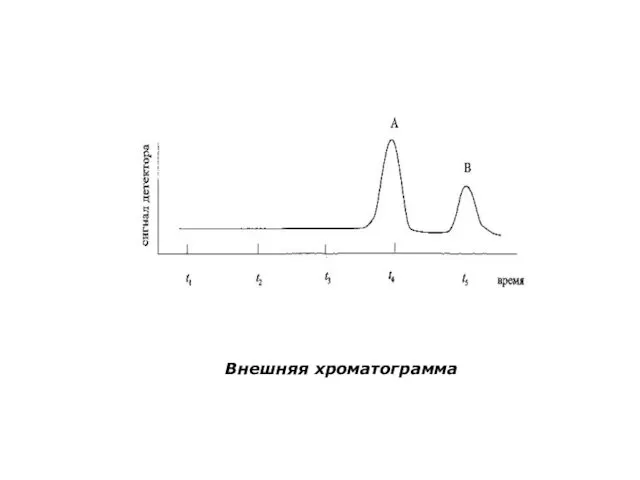
- 11. Виды хроматограмм, способы их получения Хроматограммы бывают внутренними (в плоскостной хроматографии) и внешними (в колоночной хроматографии)
- 12. Внешняя хроматограмма
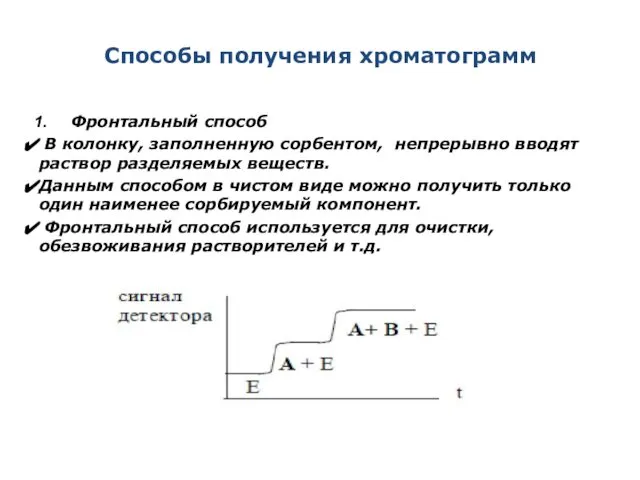
- 13. Способы получения хроматограмм Фронтальный способ В колонку, заполненную сорбентом, непрерывно вводят раствор разделяемых веществ. Данным способом
- 14. Способы получения хроматограмм 2. Вытеснительный способ. В колонку вводят порцию раствора разделяемых веществ, после чего через
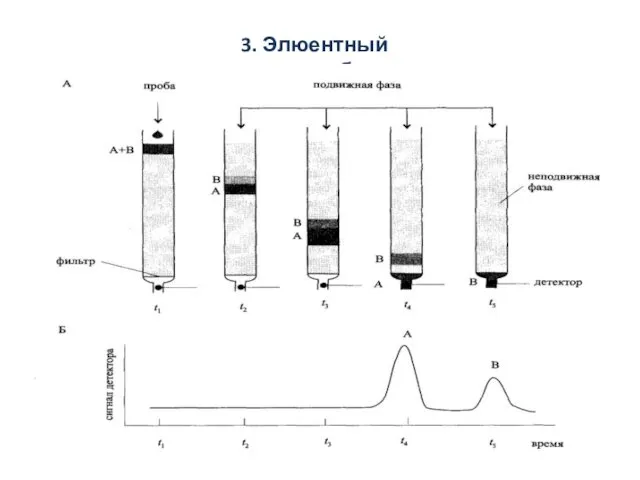
- 15. 3. Элюентный способ
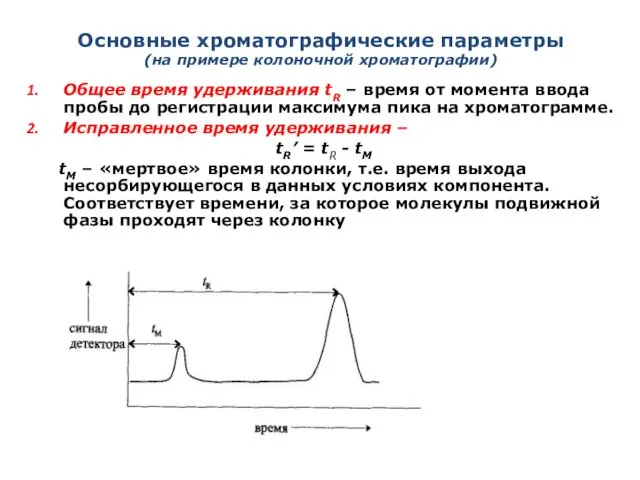
- 16. Основные хроматографические параметры (на примере колоночной хроматографии) Общее время удерживания tR – время от момента ввода
- 18. Основные хроматографические параметры 3. Удерживаемый объем VR– объем подвижной фазы, который нужно пропустить через колонку с
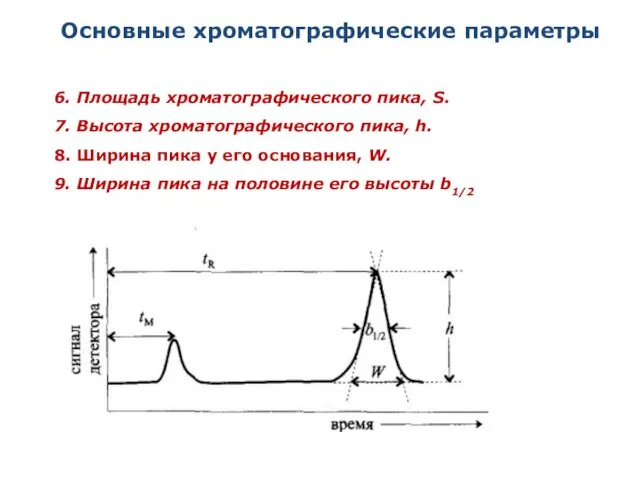
- 19. Основные хроматографические параметры 6. Площадь хроматографического пика, S. 7. Высота хроматографического пика, h. 8. Ширина пика
- 20. Теории хроматографического разделения Теория теоретических тарелок (1952 г , Мартин и Синдж, Нобелевская премия за открытие
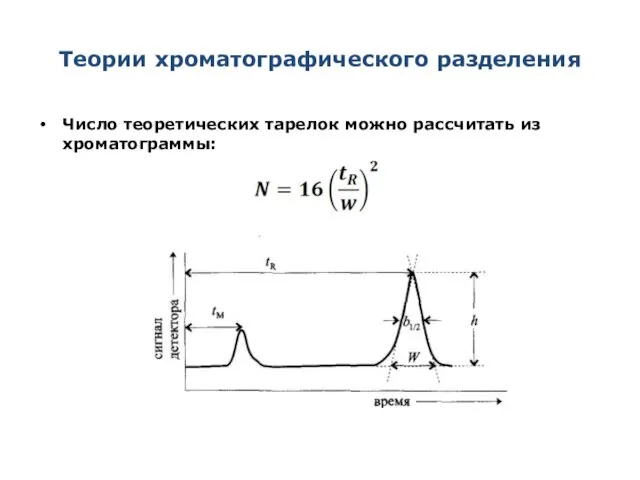
- 21. Теории хроматографического разделения Число теоретических тарелок можно рассчитать из хроматограммы:
- 22. Теория теоретических тарелок 2. Равновесие на каждой тарелке устанавливается мгновенно, до того как п.ф. переместится на
- 23. Кинетическая теория хроматографии (Ван-Деемтер и Клинкенберг) Согласно этой теории размывание хроматографического пика обусловлено следующими процессами: Уравнение
- 24. Кинетическая теория хроматографии (Ван-Деемтер и Клинкенберг) Хроматограмма вещества, полученного на колонках с разной эффективностью
- 25. Количественный анализ в колоночной хроматографии Количественный анализ в колоночной хроматографии предполагает: определение абсолютного содержания обнаруживаемых компонентов
- 26. Методы определения абсолютного содержания компонентов 1. Метод абсолютной калибровки (внешнего стандарта) Для каждого компонента смеси получают
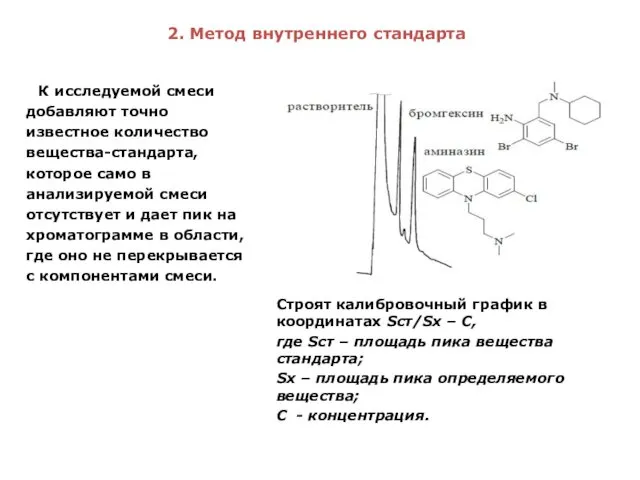
- 27. 2. Метод внутреннего стандарта Строят калибровочный график в координатах Sст/Sх – С, где Sст – площадь
- 28. Методы определения соотношения компонентов смеси 1. Метод нормировки Сумма площадей всех пиков на хроматограмме принимается за
- 29. Методы определения соотношения компонентов смеси 2. Метод нормировки с поправочными коэффициентами В случае, если отклик детектора
- 30. Качественный анализ: идентификация известных соединений Совпадение хроматографических параметров (tR, tR’, VR, VR’) неизвестного и стандартного соединений
- 31. Качественный анализ: идентификация известных соединений 2. Применение индексов удерживания Индекс удерживания данного вещества – это число,
- 33. Скачать презентацию






















 Передача и использование электроэнергии
Передача и использование электроэнергии Самоиндукция. Индуктивность
Самоиндукция. Индуктивность Основные понятия и уравнения кинематики
Основные понятия и уравнения кинематики Електростатичне поле
Електростатичне поле  Пара сил. (Лекция 3)
Пара сил. (Лекция 3) Динамика кристаллической решетки
Динамика кристаллической решетки Аттестационная работа. «Электролиз. Применение электролиза»
Аттестационная работа. «Электролиз. Применение электролиза» Исследовательский проект Машина Голдберга Ловите привет!
Исследовательский проект Машина Голдберга Ловите привет! Неравновесные состояния и необратимые процессы. Броуновское движение
Неравновесные состояния и необратимые процессы. Броуновское движение Фотоэлектрические gреобразователи
Фотоэлектрические gреобразователи МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ О
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ О Радиоактивность. Строение атома
Радиоактивность. Строение атома klass_Magnitnoe_pole_Magnitnoe_pole_toka_Magnitnye_linii
klass_Magnitnoe_pole_Magnitnoe_pole_toka_Magnitnye_linii Давление на примере ЦПГ
Давление на примере ЦПГ Тепломассообмен. Теория подобия физических явлений. Числа подобия. Уравнения подобия
Тепломассообмен. Теория подобия физических явлений. Числа подобия. Уравнения подобия Электрическая дуга
Электрическая дуга Атомная физика
Атомная физика Аномальные свойства воды
Аномальные свойства воды Магнитное поле
Магнитное поле Новое состояние материи – кварк-глюонная плазма
Новое состояние материи – кварк-глюонная плазма Циклотрон
Циклотрон Презентация по физике "Электротехника" - скачать бесплатно
Презентация по физике "Электротехника" - скачать бесплатно Классификация способов обработки материалов потоками излучения
Классификация способов обработки материалов потоками излучения Презентация Ультрафиолетовые лучи
Презентация Ультрафиолетовые лучи  Расчет стержневых конструкций по предельному равновесию
Расчет стержневых конструкций по предельному равновесию Методы разделения белковых смесей. Хроматография
Методы разделения белковых смесей. Хроматография Творческий проект ученицы 9-а класса Симоновой Ольги. Учитель: Кенжина Н. М. Учитель информатики: Умнова Т.С.
Творческий проект ученицы 9-а класса Симоновой Ольги. Учитель: Кенжина Н. М. Учитель информатики: Умнова Т.С. Кристаллы. Образование кристаллов
Кристаллы. Образование кристаллов