Содержание
- 2. Ричард Фейнман американский физик (1918 – 1988) «Если бы в результате какой-то катастрофы все накопленные знания
- 3. Основные положения МКТ Масса и размеры молекул
- 4. Теория, объясняющая тепловые свойства макроскопических тел на основе представления об их атомно – молекулярном строении, называется
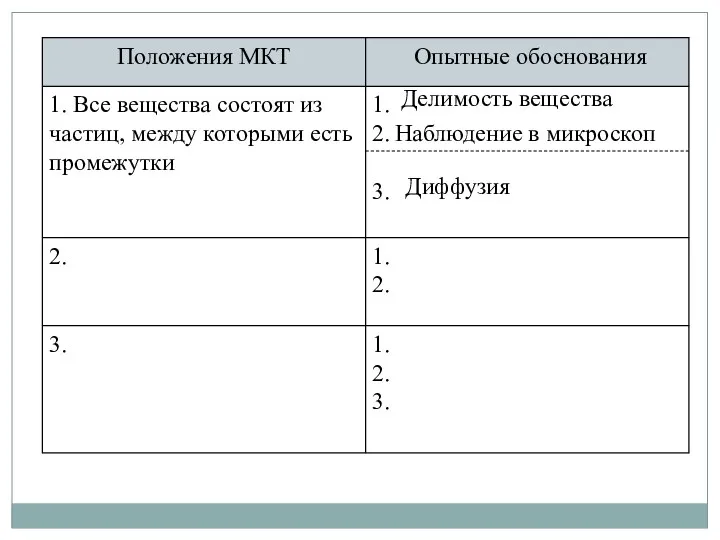
- 5. Делимость вещества Наблюдение в микроскоп Диффузия
- 6. 1. Все вещества состоят из частиц между которыми есть промежутки Частицы – это атомы, молекулы, ионы
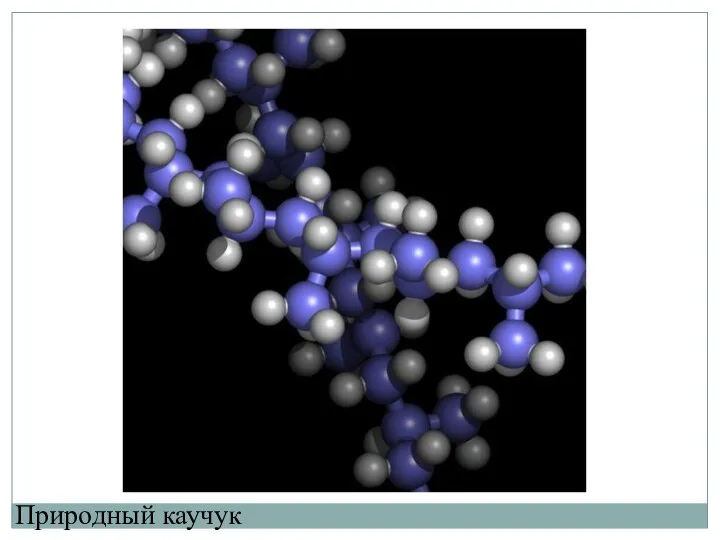
- 8. Природный каучук
- 9. Число молекул в любом теле огромно!
- 10. Молекулы имеют очень малые размеры
- 11. Определение размеров молекул
- 12. В 1951 году Эрвин Мюллер изобрёл ионный микроскоп, позволивший в деталях разглядеть атомную структуру кристаллов
- 13. Атомы кремния Атомы никеля
- 14. Диффузия – явление, заключающиеся в том, что различные вещества без внешнего воздействия смешиваются друг с другом
- 15. Наблюдение диффузии в жидкости
- 16. Примеры диффузии в газах
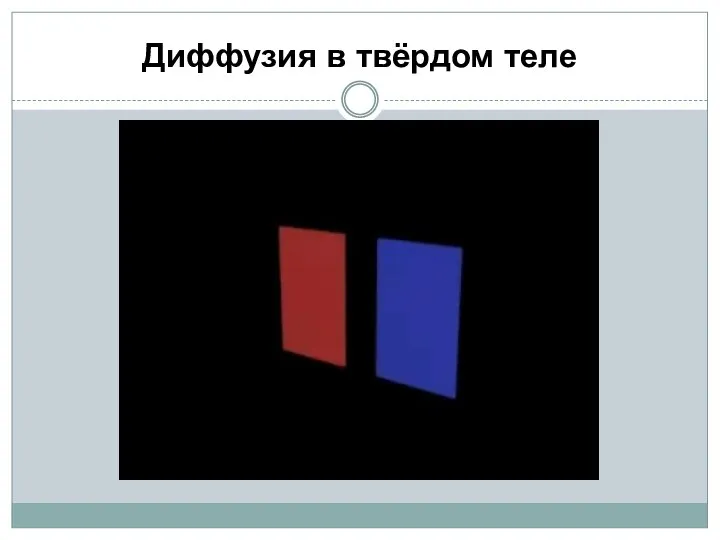
- 17. Диффузия в твёрдом теле
- 18. Броуновское движение - тепловое движение взвешенных в жидкости и газе частиц
- 19. Вопрос Что произошло бы, если бы вдруг сила притяжения частиц тела исчезла? 1. Сохранение формы твёрдого
- 20. Роль МКТ в природе, технике В организме человека и животных всасывание питательных веществ происходит через стенки
- 24. 2)Количество вещества — это величина, характеризующая количество молекул (или атомов), содержащихся в веществе Моль — это
- 26. 3) В одном моле любого вещества содержится одинаковое число молекул (атомов). Это число называется «Постоянная Авогадро»:
- 27. 4) Молярная масса – масса одного моля вещества Молярная масса и относительная молекулярная масса:
- 28. М(О2)=(2·16)·10-3=32·10-3 кг/моль М (Н2О) =(2·1 +16)·10-3= 18·10-3 кг/моль М (СО2)= (12 +2·16)·10-3= 44·10-3 кг/моль М(воздуха)=29∙10-3 кг/моль
- 32. 1) Определите массу трёх молей углекислого газа 2) Определите массу молекулы плавиковой кислоты HF
- 34. Скачать презентацию



























 Теодолиттер. Оптикалық теодолиттер
Теодолиттер. Оптикалық теодолиттер Сила Лоренца. (Лекции 15-16)
Сила Лоренца. (Лекции 15-16) Лекция №3
Лекция №3  Постоянный ток. Электрический ток в различных средах
Постоянный ток. Электрический ток в различных средах Решение задачи изгиба многослойной упругопластической пластины
Решение задачи изгиба многослойной упругопластической пластины Переходные процессы в линейных электрических цепях
Переходные процессы в линейных электрических цепях Гідростатичний парадокс Автор: Загородня Катерина, учениця 8 класу Новогуйвинської гімназії Житомирського району Житомирськ
Гідростатичний парадокс Автор: Загородня Катерина, учениця 8 класу Новогуйвинської гімназії Житомирського району Житомирськ Простая физика сложных явлений
Простая физика сложных явлений Системы единиц физических величин
Системы единиц физических величин Нерозгалужене коло з активним опором та індуктивністю
Нерозгалужене коло з активним опором та індуктивністю Электролиз меди, цинка, алюминия
Электролиз меди, цинка, алюминия Лучше Северного Сияния, только Северное Сияние…
Лучше Северного Сияния, только Северное Сияние… Определение расстояния до недоступной точки
Определение расстояния до недоступной точки Момент пары сил
Момент пары сил Презентация по физике "Производство и передача электроэнергии" - скачать бесплатно
Презентация по физике "Производство и передача электроэнергии" - скачать бесплатно Характеристики электростатического поля
Характеристики электростатического поля Напряженность заряженного шара
Напряженность заряженного шара Michael Faraday
Michael Faraday Свойства твердых тел
Свойства твердых тел Дарсонвалізація. Змінний характер струму
Дарсонвалізація. Змінний характер струму Свойства твёрдых тел, жидкостей и газов
Свойства твёрдых тел, жидкостей и газов Может ли магнит потерять свою силу
Может ли магнит потерять свою силу Магниты на основе современных массивных высокотемпературных сверхпроводников
Магниты на основе современных массивных высокотемпературных сверхпроводников Линейные электрические цепи. Постоянный ток
Линейные электрические цепи. Постоянный ток Инфракрасная спектросокопия
Инфракрасная спектросокопия Основное уравнение молекулярно-кинетической теории газов
Основное уравнение молекулярно-кинетической теории газов Измерительные приборы
Измерительные приборы Магнитное поле
Магнитное поле