Содержание
- 2. Молекулярная физика – раздел, в котором изучаются строение и свойства вещества исходя из молекулярно-кинетических представлений: все
- 3. Основные понятия МКТ Количество вещества ν – физическая величина, определяемая числом структурных элементов (атомов или молекул),
- 4. Базовая физическая модель МКТ – идеальный газ – идеализированная система (ансамбль) частиц, обладающая следующими свойствами: суммарный
- 5. Преобразуем уравнение Менделеева-Клапейрона (поделим на V ) с учетом обозначений: – число молей газа; – число
- 6. Газовые законы Закон Дальтона для смеси идеальных газов: (давление смеси идеальных газов равно сумме парциальных давлений
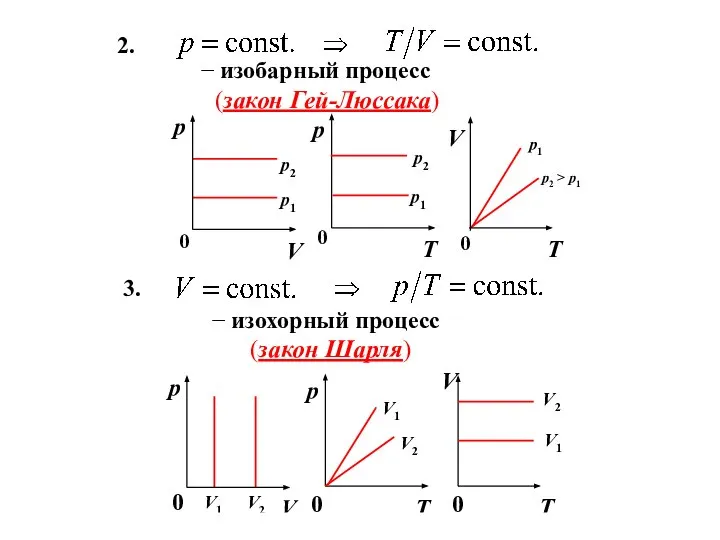
- 7. 2. − изобарный процесс (закон Гей-Люссака) 0 3. − изохорный процесс (закон Шарля)
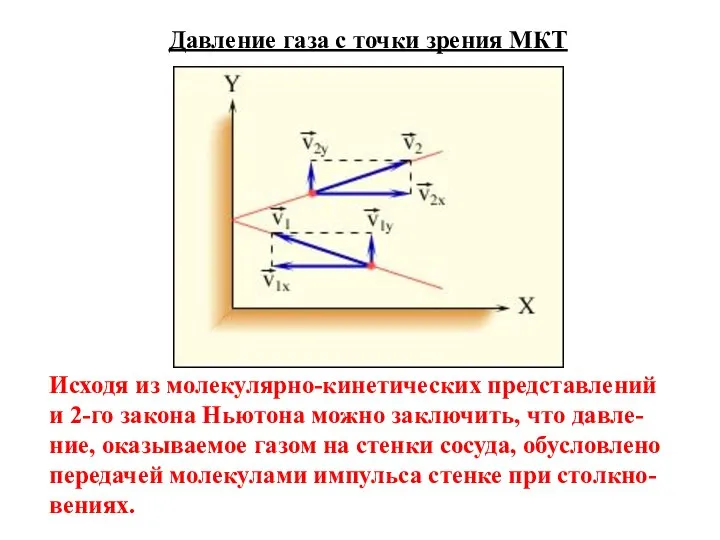
- 8. Давление газа с точки зрения МКТ Исходя из молекулярно-кинетических представлений и 2-го закона Ньютона можно заключить,
- 9. − средняя кинетическая энергия поступательного движения молекул газа. Давление идеального газа численно равно 2/3 средней кинетической
- 10. Закон равномерного распределения энергии по степеням свободы молекул Поступательно движутся одноатомные молекулы. Двух- и многоатомные молекулы,
- 11. Для средней энергии молекулы получается выражение: i = iпост + iвращ + 2iколеб − число степеней
- 12. C увеличением давления и понижением температуры поведение реального газа отличается от поведения идеаль-ного газа: средние расстояния
- 13. Уравнение Ван-дер-Ваальса для произвольной массы реального газа При а = b = 0 уравнение Ван-дер-Ваальса превращается
- 15. Скачать презентацию










 Постоянный ток. Магнитное поле
Постоянный ток. Магнитное поле Закон Ома для участка цепи, последовательное и параллельное соединение проводников
Закон Ома для участка цепи, последовательное и параллельное соединение проводников Движение по окружности
Движение по окружности Презентация по физике "Оптические линзы" - скачать
Презентация по физике "Оптические линзы" - скачать  Полупроводниковые теплоэлектрогенераторы
Полупроводниковые теплоэлектрогенераторы Презентация по физике "Всегда ли можно верить своим глазам или что такое иллюзия?" - скачать
Презентация по физике "Всегда ли можно верить своим глазам или что такое иллюзия?" - скачать  Урок физики в 9 классе Презентация урока_
Урок физики в 9 классе Презентация урока_ Увлекательный мир физики
Увлекательный мир физики Расчет статически определимых систем на подвижную нагрузку
Расчет статически определимых систем на подвижную нагрузку Исследование полей «Токов смещения»
Исследование полей «Токов смещения» Презентацию выполнил: Колесников Антон Ученик 4 класса МОУ СОШ №2 с. Целинного Руководитель: Дрозд Л. Л.
Презентацию выполнил: Колесников Антон Ученик 4 класса МОУ СОШ №2 с. Целинного Руководитель: Дрозд Л. Л.  Люминесценция
Люминесценция Движение атмосферы
Движение атмосферы Основы динамики поступательного движения механической системы
Основы динамики поступательного движения механической системы Выталкивающая сила. От чего может зависеть выталкивающая сила
Выталкивающая сила. От чего может зависеть выталкивающая сила Статистические распределения
Статистические распределения Технология проведения технического обслуживания и ремонта однодискового сцепления
Технология проведения технического обслуживания и ремонта однодискового сцепления Действие жидкости и газа на погруженное в них тело
Действие жидкости и газа на погруженное в них тело חומרים אלקטרונים הרצאה מס' 7
חומרים אלקטרונים הרצאה מס' 7 Решение задачи изгиба многослойной упругопластической пластины
Решение задачи изгиба многослойной упругопластической пластины Звезды, спектральная классификация, классы светимости, диаграмма Герцшпрунга-Рессела. (Лекция 13-14)
Звезды, спектральная классификация, классы светимости, диаграмма Герцшпрунга-Рессела. (Лекция 13-14) Идеальный газ в МКТ
Идеальный газ в МКТ Презентация Первый закон термодинамики
Презентация Первый закон термодинамики  Өлшеу түрлері. Физикалық шамалардың бірліктерін көрсету мен оларға өлшем беру негіздері
Өлшеу түрлері. Физикалық шамалардың бірліктерін көрсету мен оларға өлшем беру негіздері Автор: Ермолаева Наталья 10Б Авт
Автор: Ермолаева Наталья 10Б Авт Электротехника и электроника. Резонанс. Лекция № 7
Электротехника и электроника. Резонанс. Лекция № 7 Гальваномагнитные свойства тонких пленок висмута, легированных оловом, в интервале температуры 77-300 К
Гальваномагнитные свойства тонких пленок висмута, легированных оловом, в интервале температуры 77-300 К ФИЗИКА - наука о движении и взаимодействии материальных объектов.
ФИЗИКА - наука о движении и взаимодействии материальных объектов.