1) все тела состоят из атомов или молекул;
2) между ними существуют
силы взаимодействия;
3) атомы и молекулы находятся в беспрерывном хаотическом (тепловом) движении.
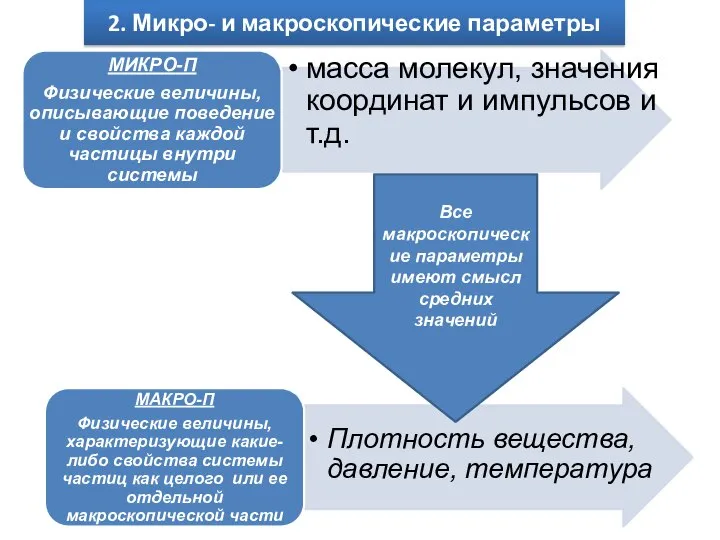
Наиболее характерной количественной мерой «большого числа частиц» является число Авогадро
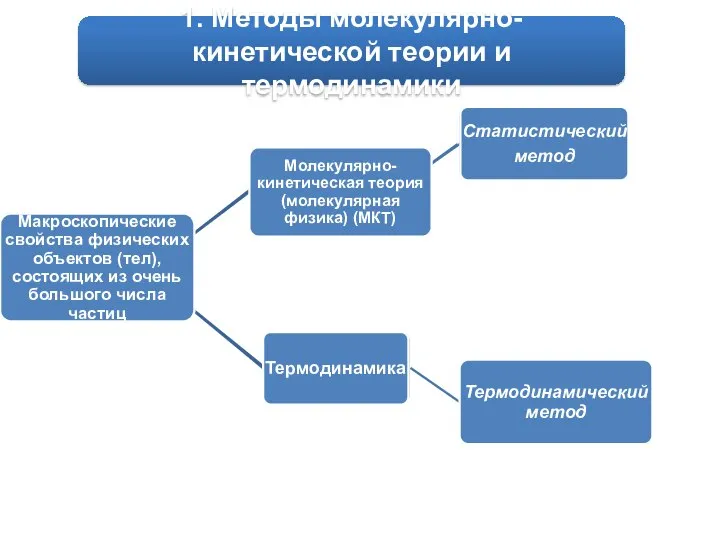
5.Основные положения МКТ:
Движение частиц может обладать двумя составляющими формами - упорядоченной и хаотичной.
Молекулярно-кинетическая теория рассматривает такие свойства тел, которые обусловлены именно полной хаотичной (беспорядочной, случайной) формой.




 Фотоэлектронные приборы (фоторезисторы, фотодиоды, фототранзисторы)
Фотоэлектронные приборы (фоторезисторы, фотодиоды, фототранзисторы) Low-Band Receive Antennas
Low-Band Receive Antennas Классификация электронных состояний двухатомных молекул
Классификация электронных состояний двухатомных молекул Непосредственные и косвенные измерения
Непосредственные и косвенные измерения Ток в разных средах
Ток в разных средах Презентация Условия плавания тел
Презентация Условия плавания тел  Гелioсейсмологiя. Диференційне обертання і сонячний цикл
Гелioсейсмологiя. Диференційне обертання і сонячний цикл А.М. НОВИКОВ Д.А. НОВИКОВ МЕТОДОЛОГИЯ НАУЧНОГО ИССЛЕДОВАНИЯ
А.М. НОВИКОВ Д.А. НОВИКОВ МЕТОДОЛОГИЯ НАУЧНОГО ИССЛЕДОВАНИЯ Нагрузки и воздействия на гидротехнические сооружения: нагрузки от судов и нагрузки и воздействия льда
Нагрузки и воздействия на гидротехнические сооружения: нагрузки от судов и нагрузки и воздействия льда Динамика относительного движения материальной точки. (Лекция 3)
Динамика относительного движения материальной точки. (Лекция 3) Магнитное поле
Магнитное поле Презентация по физике "Видимое излучение" - скачать
Презентация по физике "Видимое излучение" - скачать  Возникновение атомистической гипотезы строения вещества и ее экспериментальные доказательства. Идеальный газ
Возникновение атомистической гипотезы строения вещества и ее экспериментальные доказательства. Идеальный газ Юные Архимеды Конкурс 2013
Юные Архимеды Конкурс 2013 Полевые транзисторы FET (field-effect transistor). Устройство, принципы работы полевых транзисторов различных типов
Полевые транзисторы FET (field-effect transistor). Устройство, принципы работы полевых транзисторов различных типов Поверхности жидкостей
Поверхности жидкостей Манометры. Поршневой жидкостный насос
Манометры. Поршневой жидкостный насос Технология рентгеновских трубок. (Лекция 6)
Технология рентгеновских трубок. (Лекция 6) Разделы физики
Разделы физики Bearingless electrical motor
Bearingless electrical motor Молекулярная физика
Молекулярная физика Давление. Единицы давления
Давление. Единицы давления Презентация по физике "Правила безопасного обращения с электричеством" - скачать
Презентация по физике "Правила безопасного обращения с электричеством" - скачать  Теплопроводность газов
Теплопроводность газов Общее устройство и работа двигателя
Общее устройство и работа двигателя Электризация тел. Два рода зарядов
Электризация тел. Два рода зарядов Верификация модели
Верификация модели Сообщающиеся сосуды
Сообщающиеся сосуды