Содержание
- 5. «ОБЩИЕ СВЕДЕНИЯ О НАНОМАТЕРИАЛАХ» (ПРОДОЛЖЕНИЕ) 1. ОСНОВНЫЕ СВОЙСТВА НАНОМАТЕРИАЛОВ
- 6. Свойства наноматериалов часто сильно отличаться от свойств макроматериалов.
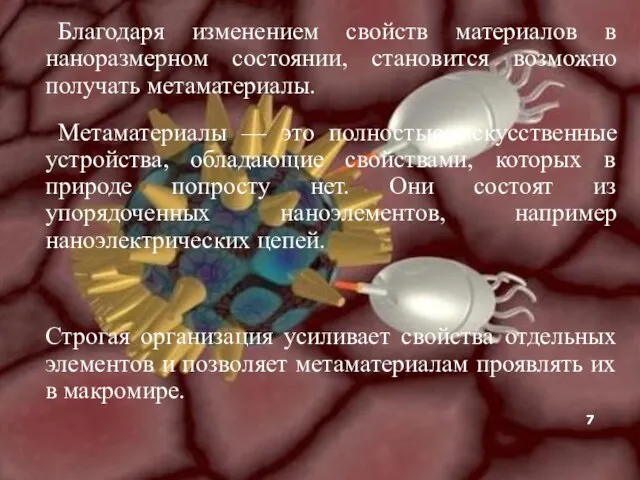
- 7. Благодаря изменением свойств материалов в наноразмерном состоянии, становится возможно получать метаматериалы. Метаматериалы — это полностью искусственные
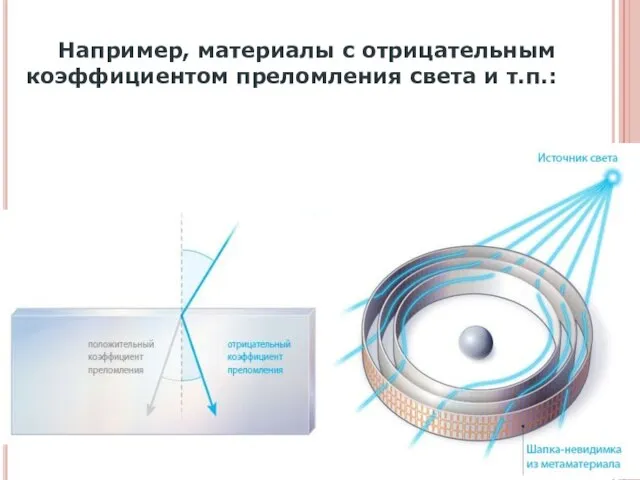
- 8. Например, материалы с отрицательным коэффициентом преломления света и т.п.:
- 9. СЕЛЕНИД КАДМИЯ В НАНОМАСШТАБЕ ФЛУОРЕСЦИРУЕТ ВСЕМИ ЦВЕТАМИ РАДУГИ, ПРИЧЕМ ЦВЕТ ЗАВИСИТ ЛИШЬ ОТ ДИАМЕТРА ЧАСТИЦ. ТАКИЕ
- 10. 2.«РАЗМЕРНЫЕ ЭФФЕКТЫ. СТРУКТУРНЫЕ, МЕХАНИЧЕСКИЕ И ТЕРМОДИНАМИЧЕСКИЕ ОСОБЕННОСТИ НАНОЧАСТИЦ И ИХ РЕАКЦИОННАЯ СПОСОБНОСТЬ»
- 11. Что такое «размерные эффекты?» Размерный эффект – зависимость удельной характеристики (или интенсивного параметра) вещества от размера
- 12. Почему же свойства материалов так сильно зависят от размера частиц?
- 13. Термодинамический подход к описанию размерных эффектов Изобарно-изотермический потенциал (энергия Гиббса) вещества описывается общим выражением: G (P,T,A)
- 14. Любая термодинамическая система стремиться уменьшить свою поверхностную энергию. Избыточная поверхностная энергия может уменьшиться за счет: уменьшения
- 15. При контакте двух фаз возникает поверхностное натяжение Поверхностное натяжение Физический смысл поверхностного натяжения рМ – внутримолекулярное
- 16. Энергетическое определение поверхностного натяжения Поверхностное натяжение (σ) – работа обратимого изотермического процесса, затраченная на образование единицы
- 17. Термодинамическое определение поверхностного натяжения При постоянных Т, р, ni, q имеем: Поверхностное натяжение - частная производная
- 18. Зависимость параметра кристаллической решетки от размера частиц Поверхность оказывает на кристалл сжимающее действие! Идеальные положения атомов
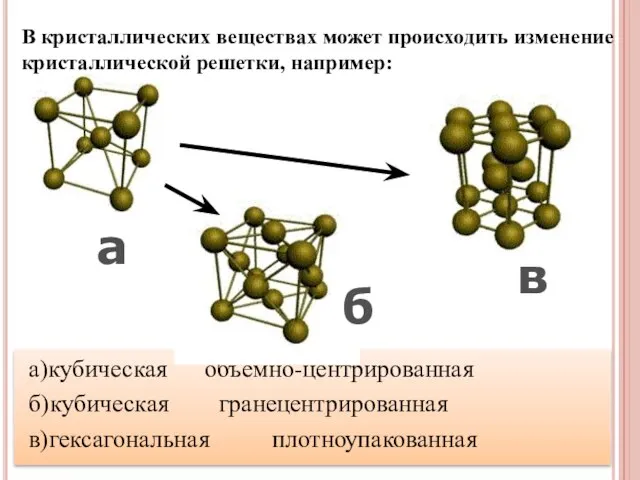
- 19. а)кубическая объемно-центрированная б)кубическая гранецентрированная в)гексагональная плотноупакованная в а б В кристаллических веществах может происходить изменение кристаллической
- 20. Другие виды упаковки наночастиц
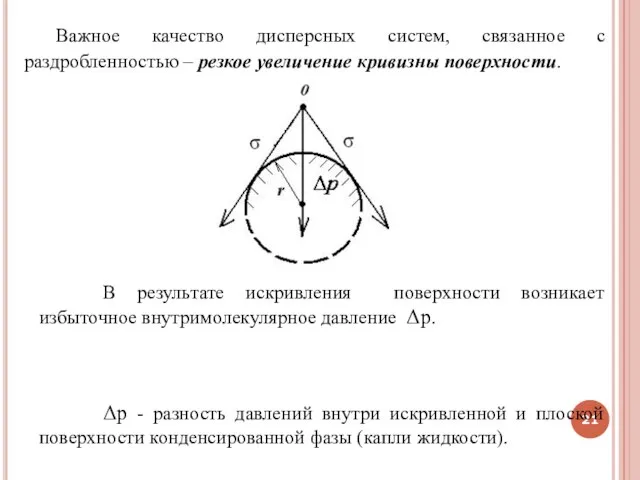
- 21. Важное качество дисперсных систем, связанное с раздробленностью – резкое увеличение кривизны поверхности. В результате искривления поверхности
- 22. Уравнение Лапласа (вывод) В результате искривления поверхности совершается работа δW, которая приводит к изменению объема тела
- 23. Приращение энергии Гиббса в результате искривления поверхности: При T=const для индивидуального вещества V=Vm, где: Vm –
- 24. Влияние дисперсности (кривизны поверхности) на различные физико-химические процессы 1. Влияние дисперсности на реакционную способность веществ Реакционная
- 25. 2. Связь дисперсности с константой равновесия Степень дисперсности вещества влияет на равновесие химической реакции. Изменение энергии
- 26. 3. Влияние дисперсности на температуру фазовых переходов С изменением дисперсности меняется температура фазового перехода веществ. При
- 27. Заменим: на Тогда получим: где: ΔТ - изменение температуры при фазовом переходе при диспергировании. Из уравнения
- 29. Скачать презентацию






















 Введение в физику нанотехнологий
Введение в физику нанотехнологий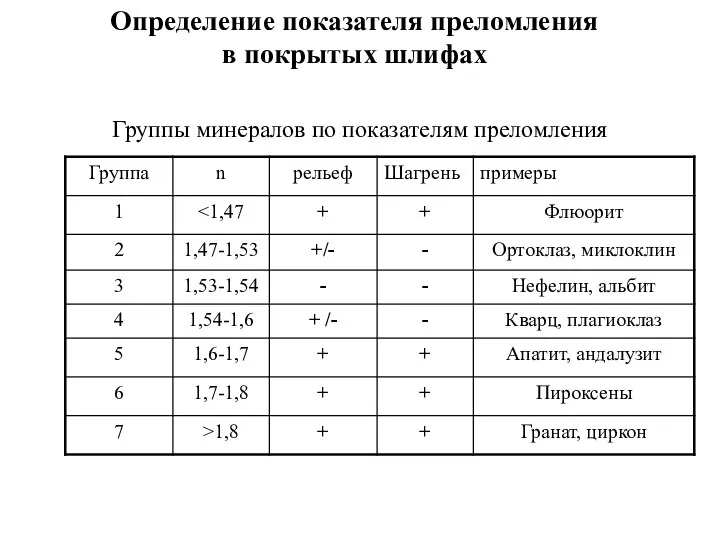 Группы минералов по показателям преломления
Группы минералов по показателям преломления Structures of water-soluble globular proteins
Structures of water-soluble globular proteins Электрическое напряжение. Единицы напряжения. Вольтметр. Измерение напряжения
Электрическое напряжение. Единицы напряжения. Вольтметр. Измерение напряжения Интернет-ресурсы, посвящённые физике
Интернет-ресурсы, посвящённые физике Визначення середньої швидкості нерівномірного руху
Визначення середньої швидкості нерівномірного руху Гідродинаміка та теплообмін при природній циркуляції у підігрівачах газу
Гідродинаміка та теплообмін при природній циркуляції у підігрівачах газу Современные ускорители элементарных частиц
Современные ускорители элементарных частиц Соединение деталей в изделии
Соединение деталей в изделии Бытовая швейная машина
Бытовая швейная машина Электромагнитные волны
Электромагнитные волны Ремонт зубчатых колес коробки подач токарных станков
Ремонт зубчатых колес коробки подач токарных станков Электромеханический этап
Электромеханический этап Смеси идеальных газов. I закон термодинамики. Внутренняя энергия и работа
Смеси идеальных газов. I закон термодинамики. Внутренняя энергия и работа Электрощит питания судов с берега. Стартерный пуск судового дизель-генератора. (Билет 13)
Электрощит питания судов с берега. Стартерный пуск судового дизель-генератора. (Билет 13) Введение. Механика - раздел курса общей физики
Введение. Механика - раздел курса общей физики Химическое действие света
Химическое действие света Использование энергии солнца на земле
Использование энергии солнца на земле Волновое поле
Волновое поле Заттың магниттік қасиеттері. Ақпараттың магниттік жазылуы
Заттың магниттік қасиеттері. Ақпараттың магниттік жазылуы Металлорежущие станки и станочные комплексы. Кинематический расчет механизмов металлорежущих станков. (Темы 3 и 4)
Металлорежущие станки и станочные комплексы. Кинематический расчет механизмов металлорежущих станков. (Темы 3 и 4) Гамма-излучение
Гамма-излучение Подъемно-транспортное оборудование
Подъемно-транспортное оборудование Магнитные свойства горных пород и руд
Магнитные свойства горных пород и руд Виробництво та передача електроенергії на відстань Електричні станції
Виробництво та передача електроенергії на відстань Електричні станції  Изобретение двигателя
Изобретение двигателя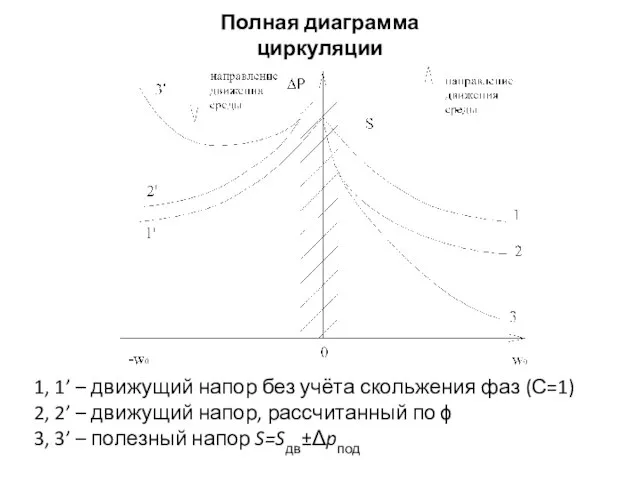 Гидродинамика. Полная диаграмма циркуляции воды в трубе
Гидродинамика. Полная диаграмма циркуляции воды в трубе Особенности САПР
Особенности САПР