Содержание
- 2. Термодинамическим определением объема является уравнение (24), которое гласит, что объем – это частная производная свободной энергии
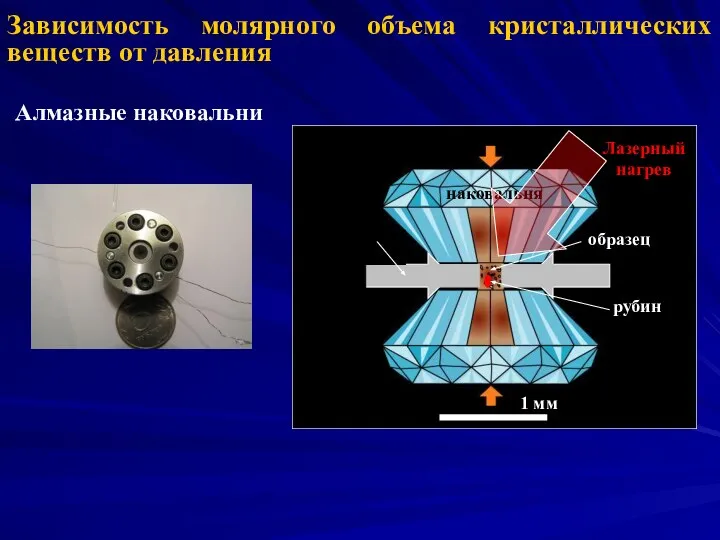
- 3. Зависимость молярного объема кристаллических веществ от давления Алмазные наковальни
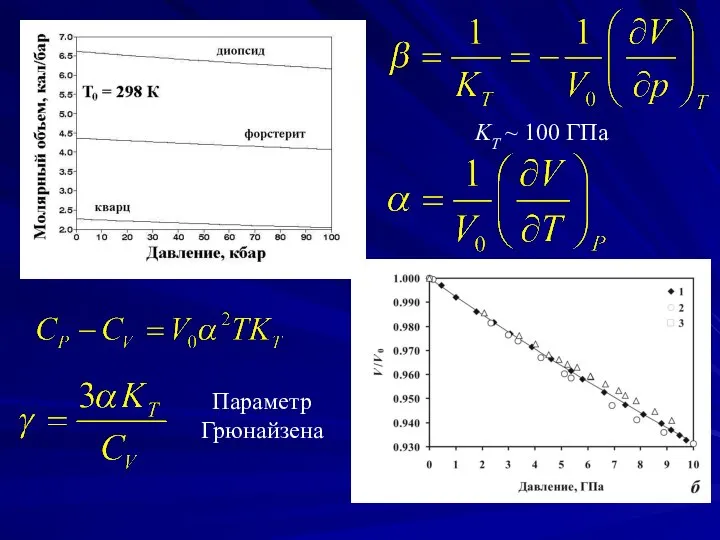
- 4. Параметр Грюнайзена KT ~ 100 ГПа
- 5. Berman & Brown (1985) Holland & Powell (1990) Holland & Powell (1998) (уравнение Берча-Мурнагана) где V0
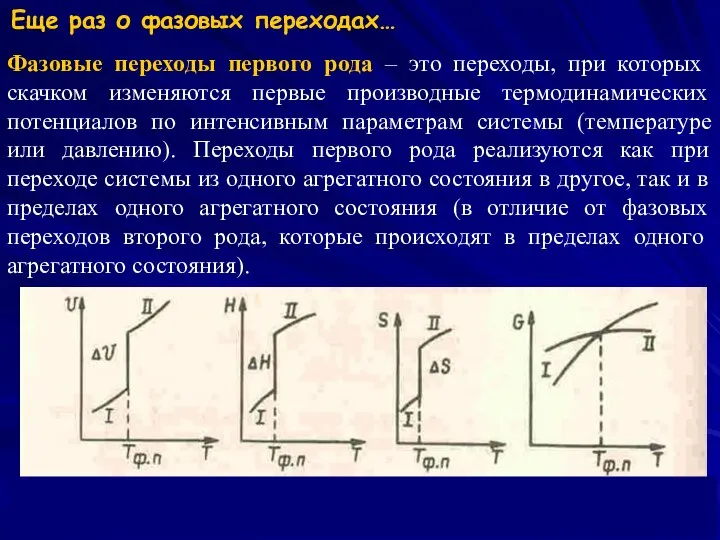
- 6. Фазовые переходы первого рода – это переходы, при которых скачком изменяются первые производные термодинамических потенциалов по
- 7. Фазовые переходы второго рода сопровождаются изменением симметрии вещества. Изменение симметрии может быть связано со смещением атомов
- 8. Термодинамические базы данных Минералогические термодинамические базы данных включают в себя данные, необходимые для расчетов реакций между
- 9. Условие равновесия. Расчет линии твердофазной реакции в Р-Т координатах. В равновесном процессе ΔG = 0. Для
- 10. Принимая во внимание соотношение dG = Vdp – SdT, получим или где ΔVr и ΔSr –
- 11. Для расчета линии реакции необходимо 1) Соблюсти условия баланса масс 2) Соблюсти условие термодинамического равновесия где
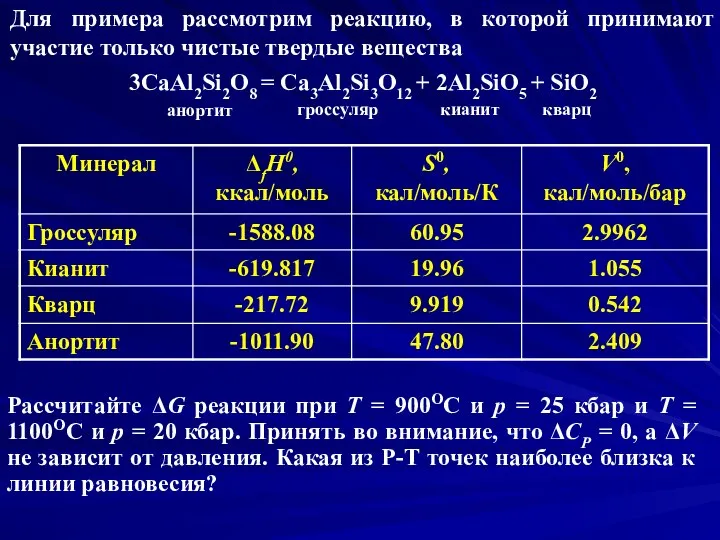
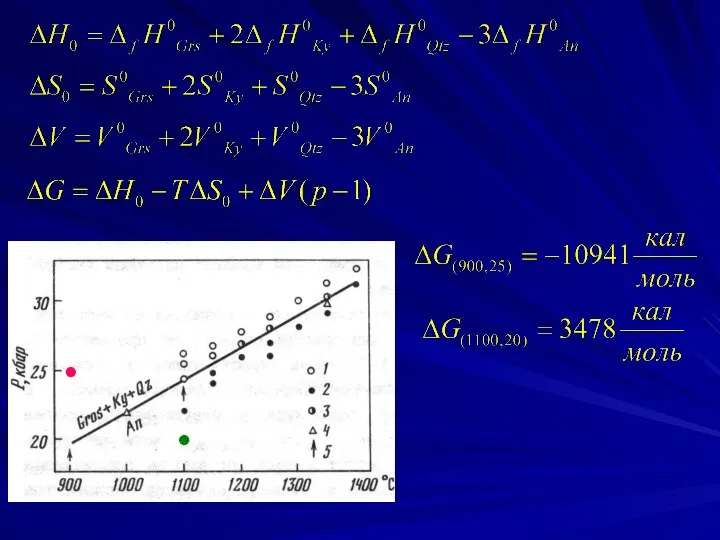
- 12. Для примера рассмотрим реакцию, в которой принимают участие только чистые твердые вещества 3CaAl2Si2O8 = Ca3Al2Si3O12 +
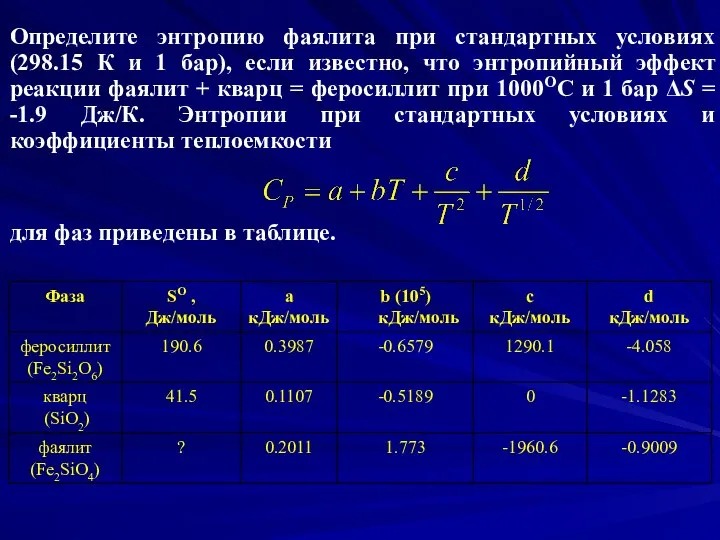
- 14. Определите энтропию фаялита при стандартных условиях (298.15 К и 1 бар), если известно, что энтропийный эффект
- 16. Скачать презентацию







 Физический диктант по теме: «Магнитное поле»
Физический диктант по теме: «Магнитное поле» Электромагнитная индукция
Электромагнитная индукция Методы измерения токов и напряжений. Метрология, стандартизация и сертификация в телекоммуникациях
Методы измерения токов и напряжений. Метрология, стандартизация и сертификация в телекоммуникациях Механическая работа, мощность. 10 класс
Механическая работа, мощность. 10 класс Плоская и пространственная система сил
Плоская и пространственная система сил Применение лазерных технологий («лазерный пинцет») для исследования динамики наномашин
Применение лазерных технологий («лазерный пинцет») для исследования динамики наномашин Основи спектроскопії. Характеристика і діапазони електромагнітного випромінювання
Основи спектроскопії. Характеристика і діапазони електромагнітного випромінювання Физико-химические методы анализа. Хроматография
Физико-химические методы анализа. Хроматография Сила тяжести. Вес тела. Сила упругости. Решение задач
Сила тяжести. Вес тела. Сила упругости. Решение задач Підготувала учениця 9 класу Нікуліна Єлизавета Вчитель: Підлубна Лілія Миколаївна Володимирівська ЗОШ І-ІІІ ст.
Підготувала учениця 9 класу Нікуліна Єлизавета Вчитель: Підлубна Лілія Миколаївна Володимирівська ЗОШ І-ІІІ ст.  Механика. Основные разделы механики
Механика. Основные разделы механики Движение в поле силы тяжести. Свободное падение
Движение в поле силы тяжести. Свободное падение Напряженность заряженного шара
Напряженность заряженного шара Сила Лоренца
Сила Лоренца урок 37. Расчёт давления жидкости на дно и стенки сосуда
урок 37. Расчёт давления жидкости на дно и стенки сосуда Электрические явления
Электрические явления Холодильные процессы
Холодильные процессы История развития электронных двигателей
История развития электронных двигателей Что изучает физика. Некоторые физические термины. Наблюдения и опыты
Что изучает физика. Некоторые физические термины. Наблюдения и опыты Биологическое действие радиации. Закон радиоактивного распада
Биологическое действие радиации. Закон радиоактивного распада Магниты. Магнитное поле, его свойства. Магнитное поле Земли
Магниты. Магнитное поле, его свойства. Магнитное поле Земли Элементы релятивистской механики. (Лекция 10)
Элементы релятивистской механики. (Лекция 10) Тезисы. Естественное освещение. КЕО
Тезисы. Естественное освещение. КЕО Основы гидравлики
Основы гидравлики Створення моделі іонного двигуна та дослідження його характеристик
Створення моделі іонного двигуна та дослідження його характеристик Атом и атомное ядро
Атом и атомное ядро Информационное моделирование заводной сектор мотоцикла Минск
Информационное моделирование заводной сектор мотоцикла Минск Физические основы телевидения.
Физические основы телевидения.