Содержание
- 2. Отыщи всему начало, и ты многое поймешь. Козьма Прутков 400 г. до н.э. Демокрит: «Существует предел
- 3. 1897. Джозеф Джон Томсон (1856 – 1940). Определил заряд и массу отдельного «атома» электричества. В природе
- 4. Модель атома Томсона Явление радиоактивности давало основания предположить, что в состав атома входят отрицательно и положительно
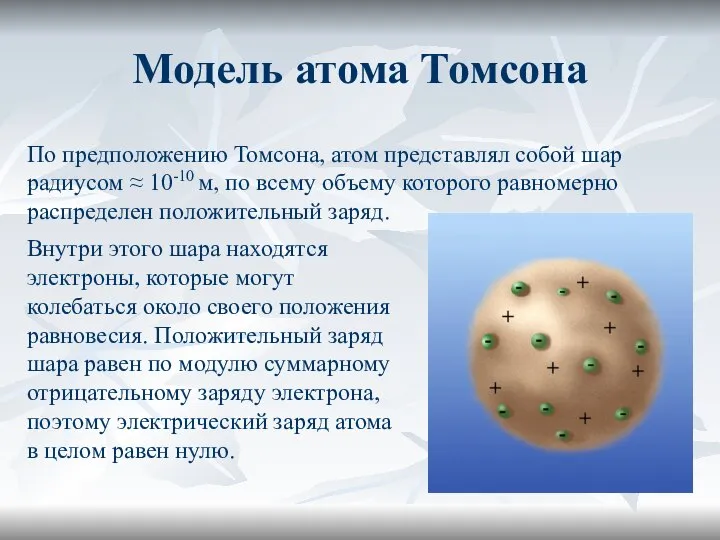
- 5. Модель атома Томсона В 1903г. английский физик Джозеф Джон Томсон предложил одну из первых моделей строения
- 6. Модель атома Томсона Внутри этого шара находятся электроны, которые могут колебаться около своего положения равновесия. Положительный
- 7. Опыт Резерфорда Модель строения атома Томсона нуждалась в экспериментальной проверке. Важно было проверить, действительно ли положительный
- 8. Идея опыта Зондировать атом альфа–частицами. Альфа-частицы возникают при распаде радия. Масса альфа-частицы в 8000 раз больше
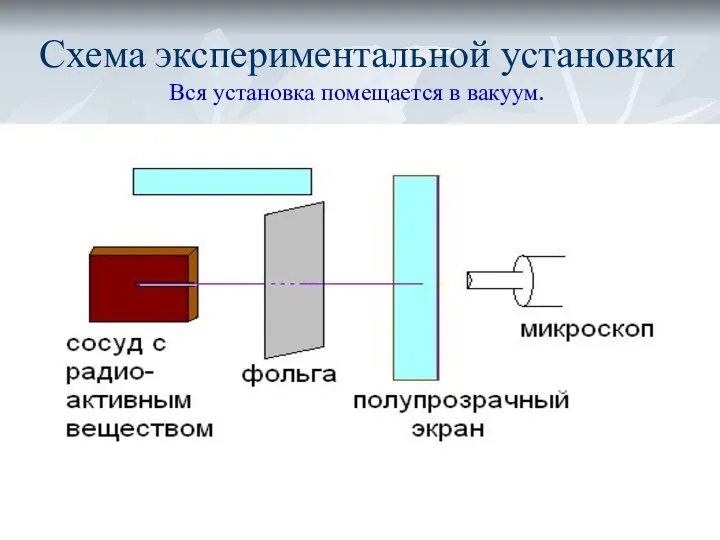
- 9. Схема экспериментальной установки Вся установка помещается в вакуум.
- 10. В отсутствии фольги – на экране появлялся светлый кружок напротив канала с радиоактивным веществом.
- 11. Когда на пути пучка альфа-частиц поместили фольгу, площадь пятна на экране увеличилась. Помещая экран сверху и
- 12. Выводы из опыта Резерфорда Именно случаи рассеяния α-частиц на большие углы привели Резерфорда к выводу: Столь
- 13. Выводы из опыта Резерфорда Поскольку масса электрона примерно в 8 000 раз меньше массы α-частицы, электроны,
- 14. Модель атома Резерфорда В центре атома находится положительно заряженное ядро, вокруг которого вращаются по определенным орбитам
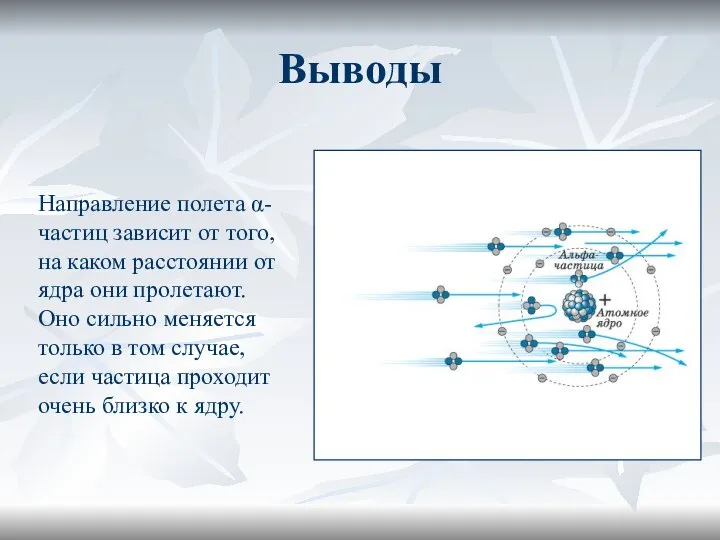
- 15. Выводы Направление полета α-частиц зависит от того, на каком расстоянии от ядра они пролетают. Оно сильно
- 16. Выводы Таким образом, в результате опытов по рассеянию α-частиц была доказана несостоятельность модели атома Томсона, выдвинута
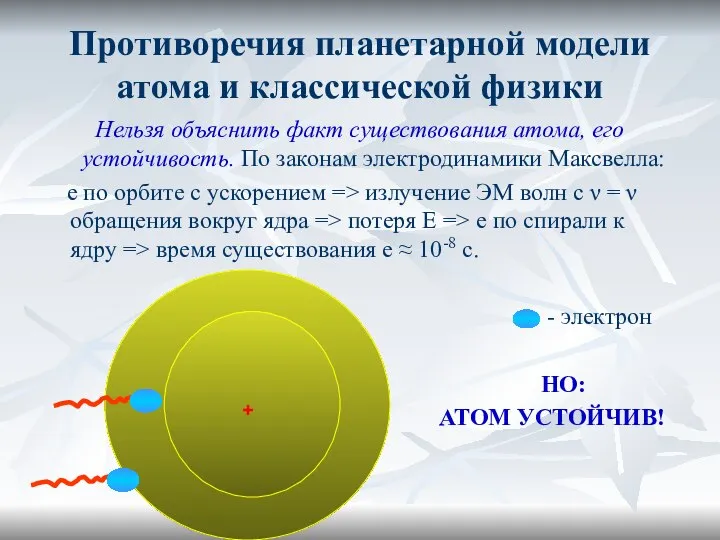
- 17. Противоречия планетарной модели атома и классической физики Нельзя объяснить факт существования атома, его устойчивость. По законам
- 18. Первый постулат Бора Атомная система может находится только в особых стационарных квантовых состояниях, каждому из которых
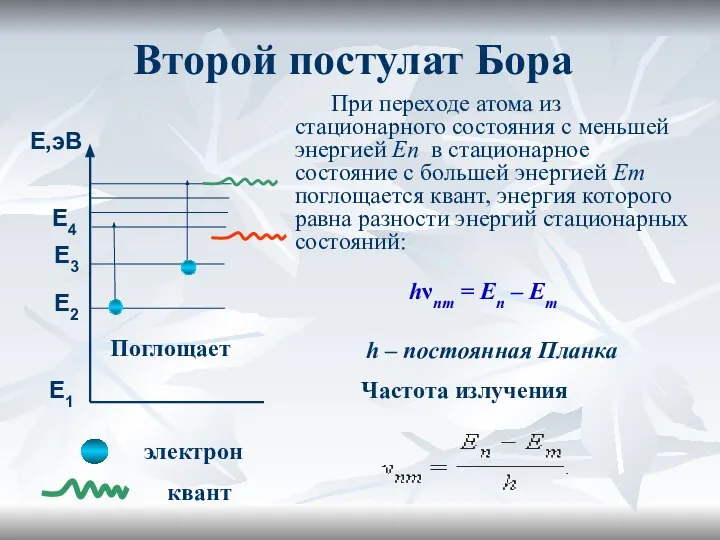
- 19. Второй постулат Бора При переходе атома из стационарного состояния с большей энергией En в стационарное состояние
- 20. Второй постулат Бора При переходе атома из стационарного состояния с меньшей энергией En в стационарное состояние
- 21. Энергетические диаграммы Е1 Е2 Е3 Е,эВ Е4 Энергетический уровень (стационарное состояние) Нормальное состояние атома Е1 -
- 22. Правило квантования Бора В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные
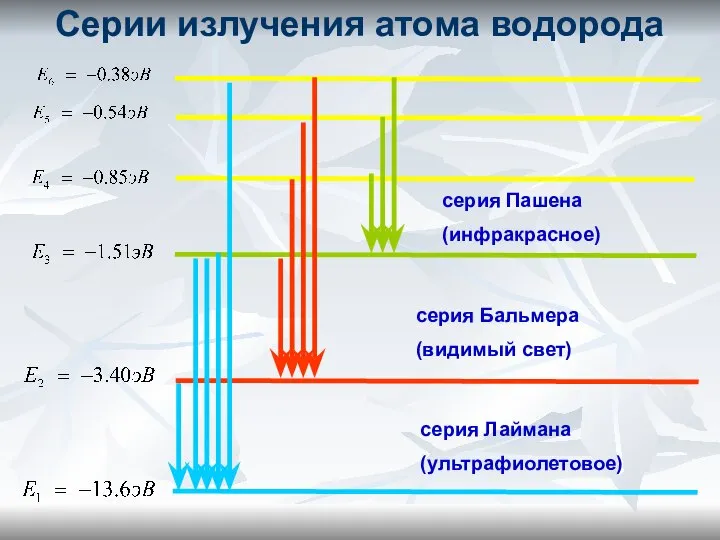
- 23. Серии излучения атома водорода серия Пашена (инфракрасное) серия Лаймана (ультрафиолетовое) серия Бальмера (видимый свет)
- 24. Достоинства теории Бора Позволила объяснить, почему атомы испускают линейчатые спектры и точно предсказать для атома водорода
- 26. Скачать презентацию

















 Сила тока. Плотность тока. Уравнение неразрывности
Сила тока. Плотность тока. Уравнение неразрывности Реактивний двигун — двигун-рушій, що створює тягу (реактивну) внаслідок швидкого витікання робочого тіла із сопла, найчастіше
Реактивний двигун — двигун-рушій, що створює тягу (реактивну) внаслідок швидкого витікання робочого тіла із сопла, найчастіше  Картография. Геодезические сети и датумы
Картография. Геодезические сети и датумы Физика колебаний и волн. Спектральное разложение света. (Лекция 4)
Физика колебаний и волн. Спектральное разложение света. (Лекция 4) Презентация по физике Удельная теплота плавления
Презентация по физике Удельная теплота плавления  Дифференциальные защиты шин, ошиновок, трансформаторов. Алгоритм работы. Взаимодействие с устройствами РЗА
Дифференциальные защиты шин, ошиновок, трансформаторов. Алгоритм работы. Взаимодействие с устройствами РЗА Анализ технико-экономической эффективности КПГУ на базе паротурбинной установки ПТ-135/165-130/15
Анализ технико-экономической эффективности КПГУ на базе паротурбинной установки ПТ-135/165-130/15 Электричество, электромагнитные волны и магнетизм
Электричество, электромагнитные волны и магнетизм Будівельна механіка машин. Лекція 1. Предмет, задачі і порядок вивчення дисципліни
Будівельна механіка машин. Лекція 1. Предмет, задачі і порядок вивчення дисципліни Тема 7 Валы и оси. Опоры скольжения и качения. Уплотнительные устройства. Упругие элементы. Муфты.
Тема 7 Валы и оси. Опоры скольжения и качения. Уплотнительные устройства. Упругие элементы. Муфты.  Электроэнергетика Мира Электроэнергетика – одна из отраслей «авангардной тройки»
Электроэнергетика Мира Электроэнергетика – одна из отраслей «авангардной тройки» Стенд для визуального изучения электромагнитных полей
Стенд для визуального изучения электромагнитных полей Электризация тел
Электризация тел Электрическая система. (Лекция 1)
Электрическая система. (Лекция 1) Телеграфный аппарат и азбука Морзе
Телеграфный аппарат и азбука Морзе Знакомство с радиопередающем устройством
Знакомство с радиопередающем устройством Теплопроводность. Основные положения теории теплопроводности. (Тема 4. Лекции 14,15)
Теплопроводность. Основные положения теории теплопроводности. (Тема 4. Лекции 14,15) Презентация по физике "Учебно-методический комплекс. Физика, 10 класс" - скачать
Презентация по физике "Учебно-методический комплекс. Физика, 10 класс" - скачать  Закон всемирного тяготения
Закон всемирного тяготения Граничные условия для электромагнитного поля
Граничные условия для электромагнитного поля Термоядерная реакция
Термоядерная реакция  Лекция 35. Дифракция света
Лекция 35. Дифракция света Машиноведение. 5 класс. История создания швейных машин. Устройство бытовой швейной машины
Машиноведение. 5 класс. История создания швейных машин. Устройство бытовой швейной машины лекция №4 для студентов 1 курса, обучающихся по специальности 060201 - Стоматология К.п.н., доцент Шилина Н.Г. Красноярск, 2012 Тема:
лекция №4 для студентов 1 курса, обучающихся по специальности 060201 - Стоматология К.п.н., доцент Шилина Н.Г. Красноярск, 2012 Тема:  Великий адронний колайдер
Великий адронний колайдер Электрический ток
Электрический ток Единицы работы электрического тока, применяемые на практике
Единицы работы электрического тока, применяемые на практике Поняття про полімери. Будова та їх властивості
Поняття про полімери. Будова та їх властивості