Содержание
- 2. Статистический и термодинамический методы исследования Молекулярная физика и термодинамика — изучают макроскопические процессы в телах, связанные
- 3. Процессы, изучаемые молекулярной физикой и термодинамикой, являются результатом совокупного действия огромного числа молекул. (Число Лошмидта NL
- 4. Свойства макроскопической системы определяются свойствами частиц системы, особенностями их движения, усредненными значениями динамических характеристик этих частиц
- 5. Термодинамический метод. Задача — определение состояния термодинамической системы. Состояние системы задается термодинамическими параметрами (параметрами состояния) —
- 6. Давление p = F/S; S – площадь, на которую действует сила F. [p] = 1Н/1м2 =
- 7. Температура — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Две температурные шкалы термодинамическая - Кельвины
- 8. Термодинамическая температурная шкала определяется по одной реперной точке: тройная точка воды (температура, при которой лед, вода
- 9. В молекулярно-кинетической теории пользуются моделью идеального газа: 1) собственный объем молекул газа пренебрежимо мал по сравнению
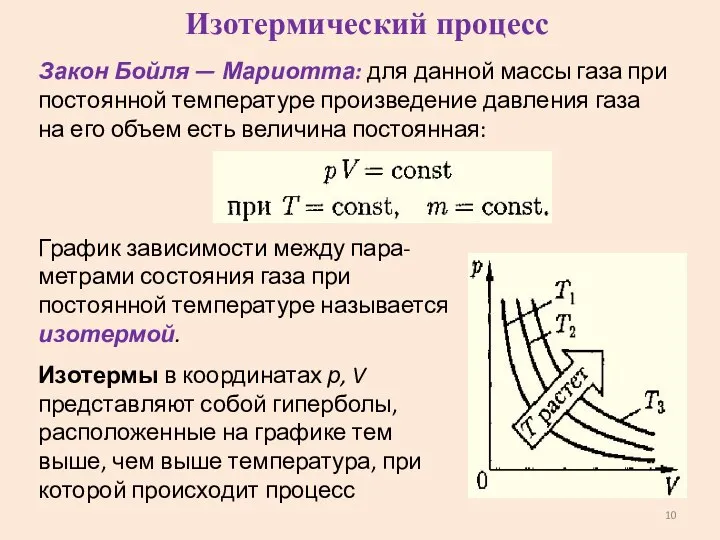
- 10. Закон Бойля — Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его
- 11. Закон Гей-Люссака: объем данной массы газа при постоянном давлении изменяется линейно с температурой: Процесс, протекающий при
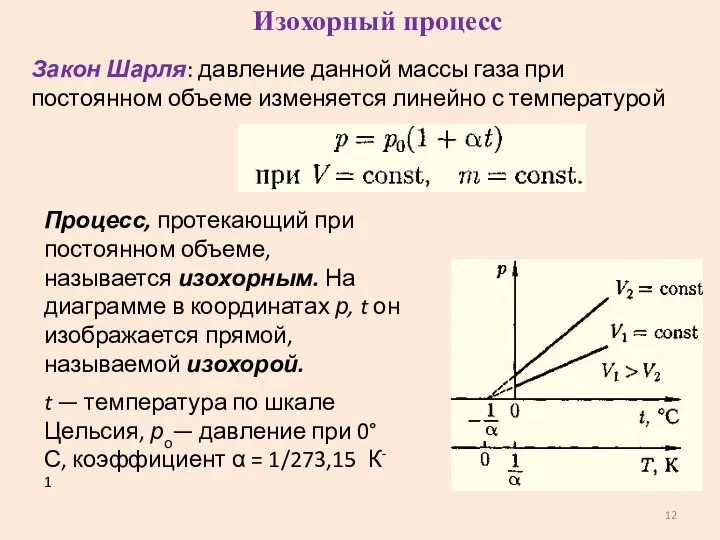
- 12. Закон Шарля: давление данной массы газа при постоянном объеме изменяется линейно с температурой Процесс, протекающий при
- 13. T = 273,15 + t α = 1/273,15 1+ αt = αT V = Vo(1+ αt)
- 14. Закон Авогадро: 1 моль любого газа при одинаковых температуре и давлении занимает одинаковый объем При нормальных
- 15. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений р1, р2, ..., рn входящих в
- 16. Уравнение Клапейрона—Менделеева Состояние некоторой массы m газа определяется тремя термодинамическими параметрами: давление р (Па) объем V
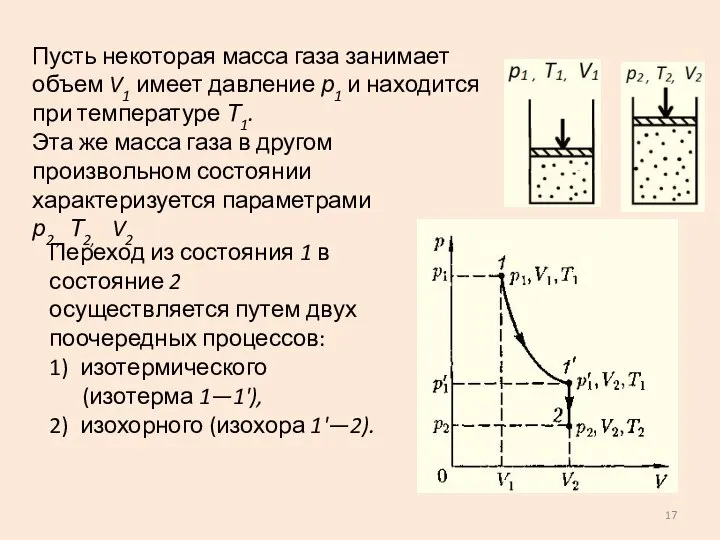
- 17. Пусть некоторая масса газа занимает объем V1 имеет давление р1 и находится при температуре Т1. Эта
- 18. По закону Бойля-Мариотта: (изотермический процесс) По закону Гей-Люссака: (изохорный процесс) Это уравнение Клапейрона В — газовая
- 19. Русский ученый Д.И. Менделеев (1834—1907) объединил уравнение Клапейрона с законом Авогадро, записав это уравнение для 1
- 20. pVm = RT
- 21. Можно перейти к уравнению Клапейрона-Менделеева для произвольной массы газа. Если при некоторых заданных давлении и температуре
- 22. Введем постоянную Больцмана k: R – молярная газовая постоянная NA – постоянная Авогадро Тогда уравнение состояния
- 23. Из уравнения р = nкТ следует, что давление идеального газа при данной температуре T пропорционально концентрации
- 24. Основное уравнение молекулярно-кинетической теории идеальных газов Согласно модели идеального газа соударения молекул со стенками сосуда абсолютно
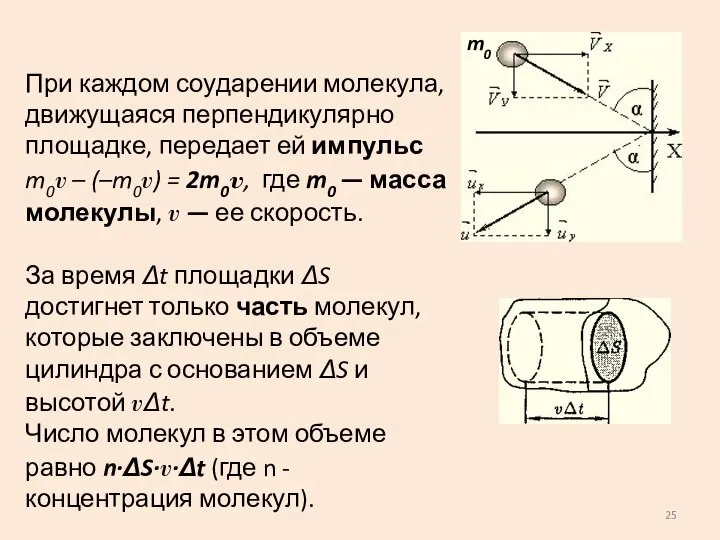
- 25. При каждом соударении молекула, движущаяся перпендикулярно площадке, передает ей импульс m0v – (–m0v) = 2m0v, где
- 26. Рассчитаем давление газа, оказываемое им на стенку сосуда за счет передачи импульса при ударах молекул о
- 27. Хаотическое движение молекул заменим движением вдоль трех взаимно перпендикулярных направлений, так что в любой момент времени
- 28. Тогда давление газа, оказываемое им на стенку сосуда (если все молекулы движутся с одинаковой скоростью v
- 29. Е — суммарная кинетическая энергия поступательного движения всех молекул газа в объеме V Так как масса
- 30. Для 1 моль газа т = М (М—молярная масса), поэтому Где Vm — молярный объем По
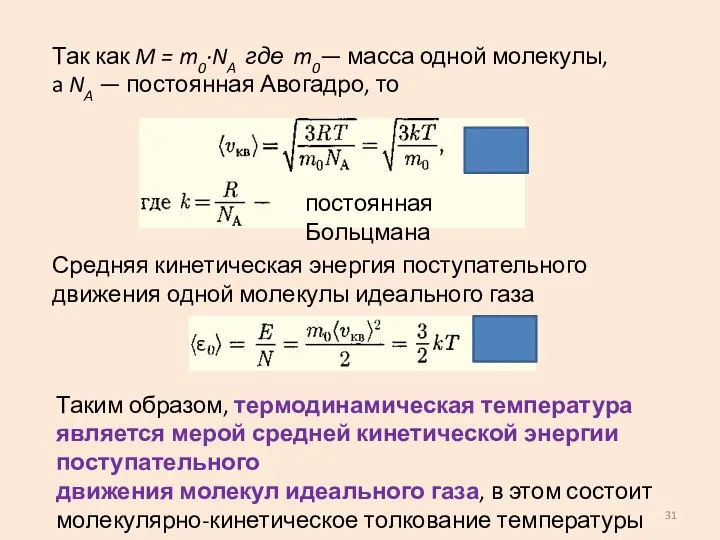
- 31. Так как M = m0·NA где m0— масса одной молекулы, a NA — постоянная Авогадро, то
- 32. При предельно низких температурах (близких к 0 К) это выражение не справедливо, т. е. средняя кинетическая
- 34. Контрольные вопросы 1. Сформулируйте основные представления молекулярно-кинетической теории. 2. Назовите две шкалы температур, какова связь между
- 35. Контрольные вопросы 9. Какие три параметра определяют состояние газа? 10. Что такое молярный объем газа? Сформулируйте
- 37. Скачать презентацию





























 Моделирование геомеханических процессов. Тема 11. Лекция № 16
Моделирование геомеханических процессов. Тема 11. Лекция № 16 Свет и световые явления
Свет и световые явления Истечение жидкости через отверстия
Истечение жидкости через отверстия Волоконна оптика
Волоконна оптика  Численное моделирование в среде Geant4 элементов протонной радиографической установки
Численное моделирование в среде Geant4 элементов протонной радиографической установки Ремонт передней подвески автомобиля ВАЗ-2170 LADA Priora
Ремонт передней подвески автомобиля ВАЗ-2170 LADA Priora Расчёт ТКЗ схемы замещения
Расчёт ТКЗ схемы замещения Подшипники. Конструкция подшипника скольжения
Подшипники. Конструкция подшипника скольжения Презентация по физике "Электромагнитное взаимодействие частиц с веществом" - скачать
Презентация по физике "Электромагнитное взаимодействие частиц с веществом" - скачать  ВЫПОЛНИЛА УЧЕНИЦА 8«Б» КЛАССА СРЕДНЕЙ ШКОЛЫ №13 Елагина М.В. НАУЧНЫЙ РУКОВОДИТЕЛЬ СИЛКИНА С.В. Презентация по проекту «Энергосбер
ВЫПОЛНИЛА УЧЕНИЦА 8«Б» КЛАССА СРЕДНЕЙ ШКОЛЫ №13 Елагина М.В. НАУЧНЫЙ РУКОВОДИТЕЛЬ СИЛКИНА С.В. Презентация по проекту «Энергосбер Двигатели постоянного и переменного тока. Бесколлекторные и щеточные двигатели
Двигатели постоянного и переменного тока. Бесколлекторные и щеточные двигатели Закон Ома для участка цепи. Сопротивление
Закон Ома для участка цепи. Сопротивление Презентация по физике СПЕКТР ЭЛЕКТРОМАГНИТНЫХ ВОЛН
Презентация по физике СПЕКТР ЭЛЕКТРОМАГНИТНЫХ ВОЛН  Цепные передачи. Общие сведения. Геометрия и кинематика передачи. Устройство цепи и звездочек. Лекция 2
Цепные передачи. Общие сведения. Геометрия и кинематика передачи. Устройство цепи и звездочек. Лекция 2 Квантовые состояния многоэлектронных атомов. Правило Хунда
Квантовые состояния многоэлектронных атомов. Правило Хунда Общие сведения о системах электросвязи
Общие сведения о системах электросвязи Воздухопроницаемость – свойство ОК пропускать воздух
Воздухопроницаемость – свойство ОК пропускать воздух Бойове застосування КЗА 86Ж6. Система електроживлення, вентиляції, кондиціювання. Технологічне обладнання 86Ж6. (Тема 9.4)
Бойове застосування КЗА 86Ж6. Система електроживлення, вентиляції, кондиціювання. Технологічне обладнання 86Ж6. (Тема 9.4) Magnetic field
Magnetic field Составитель: Гринякин Станислав Александрович Руководитель: Талалай Ольга Георгиевна, учитель физики
Составитель: Гринякин Станислав Александрович Руководитель: Талалай Ольга Георгиевна, учитель физики Дифракция света
Дифракция света Линзы. Оптическая сила линзы
Линзы. Оптическая сила линзы Презентация по физике "Сила" - скачать
Презентация по физике "Сила" - скачать  Элементарные частицы
Элементарные частицы Speech Recognition and Synthesis. Waveform Synthesis (in Concatenative TTS)
Speech Recognition and Synthesis. Waveform Synthesis (in Concatenative TTS) Инструментарий нанотехнологий. Оптическая и электронная микроскопия. Практика 3, 4
Инструментарий нанотехнологий. Оптическая и электронная микроскопия. Практика 3, 4 Электролиз. История создания. Применение
Электролиз. История создания. Применение Световые волны
Световые волны