Содержание
- 2. Термодинамика Термодинамика – это раздел физики, занимающийся изучением общих свойств вещества, связанных с тепловым движением. Термодинамика
- 3. Температура Температурой называется физическая величина, определяющая «степень нагретости» тел и характеризующая состояние термодинамического равновесия системы. Температура
- 4. Термодинамическая шкала температур В физике наиболее часто используется термодинамическая шкала температур (шкала Кельвина). Единицей температуры по
- 5. Температурные шкалы Температура по шкале Цельсия t°С связана с термодинамической температурой T соотношением, причем точке кристаллизации
- 6. Абсолютный нуль температуры Температура T = 0 К называется абсолютным нулем температуры. Это самая низкая из
- 7. Характерные значения температур в природе и технике
- 8. 3.2 Термодинамические процессы ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- 9. Равновесное состояние термодинамической системы Равновесным состоянием термодинамической системы называется состояние, при котором все параметры, характеризующие систему,
- 10. Термодинамический процесс Термодинамическим процессом называется изменение хотя бы одного из параметров состояния термодинамической системы. Обычно в
- 11. Графическое изображение состояния и процесса Состояния термодинамической системы, а также термодинамические процессы удобно изображать на диаграмме
- 12. 3.3 Внутренняя энергия идеального газа. Работа. Количество теплоты ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- 13. Работа идеального газа При бесконечном малом изменении объема термодинамической системы на величину dV совершается элементарная работа
- 14. Графическое представление работы идеального газа Работа численно равна площади на pV-диаграмме состояний, ограниченной осью V, вертикальными
- 15. Внутренняя энергия термодинамической системы Важной физической величиной, характеризующей равновесное состояние термодинамической системы, является внутренняя энергия U
- 16. Свойства внутренней энергии Внутренняя энергия определена с точностью до произвольной постоянной. Поскольку в термодинамических системах внутримолекулярная
- 17. Внутренняя энергия идеального газа Для идеального газа потенциальная энергия взаимодействия между молекулами равна нулю: Πвз =
- 18. Внутренняя энергия смеси идеальных газов Внутренняя энергия смеси идеальных газов находится по формуле Здесь νсм –
- 19. Количество теплоты При приведении в соприкосновение двух термодинамических систем их внутренняя энергия изменяется. Такой процесс обмена
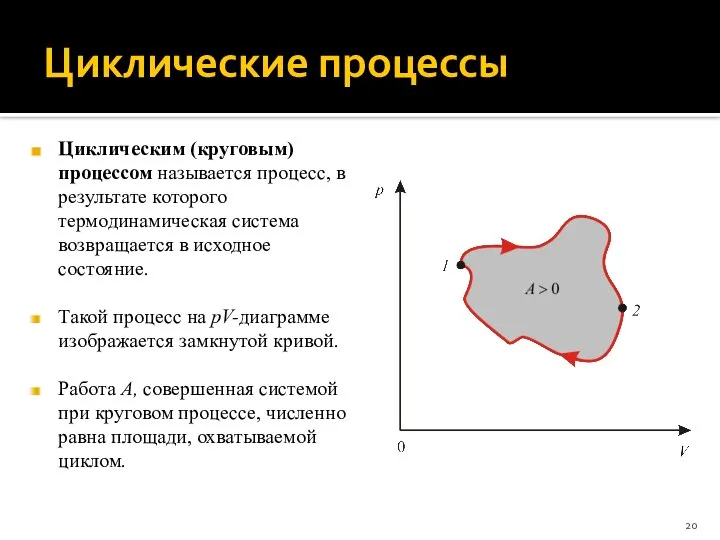
- 20. Циклические процессы Циклическим (круговым) процессом называется процесс, в результате которого термодинамическая система возвращается в исходное состояние.
- 21. 3.4 Первое начало термодинамики ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- 22. Первое начало термодинамики Первое начало термодинамики представляет собой закон сохранения энергии для тепловых процессов и устанавливает
- 23. Дифференциальная форма первого начала термодинамики В дифференциальной форме первое начало термодинамики имеет следующий вид: Бесконечно малое
- 24. Дифференциальная форма первого начала термодинамики Бесконечно малые величины (не приращения!) δA и δQ представляют собой элементарные
- 25. Первое начало термодинамики и perpetuum mobile Применительно к вечному двигателю первое начало термодинамики формулируется так: вечный
- 26. 3.5 Теплоемкость ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- 27. Теплоемкость тела Теплоемкостью тела Стела называется количество теплоты, которое нужно сообщить телу, чтобы повысить его температуру
- 28. Удельная и молярная теплоемкости Удельной теплоемкостью с называется теплоемкость единицы массы вещества (количество теплоты, которое нужно
- 29. Связь между c и Q Найдем количество теплоты Q, которое нужно сообщить телу массы m для
- 30. Молярная теплоемкость при постоянном объме Наибольший интерес представляют теплоемкости процессов, в которых объем или давления являются
- 31. Молярная теплоемкость при постоянном давлении Молярная теплоемкость газа при постоянном давлении Разность теплоемкостей: Из уравнения состояния
- 32. Уравнение Майера Таким образом, получаем уравнение Майера, из которого определим физический смысл универсальной газовой постоянной: Универсальная
- 33. Молярные теплоемкости и число степеней свободы молекул газа Молярные теплоемкости CV и Cp идеального газа выражаются
- 34. Выражение теплоемкостей и внутренней энергии идеального газа через постоянную адиабаты
- 35. 3.6 Изопроцессы ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
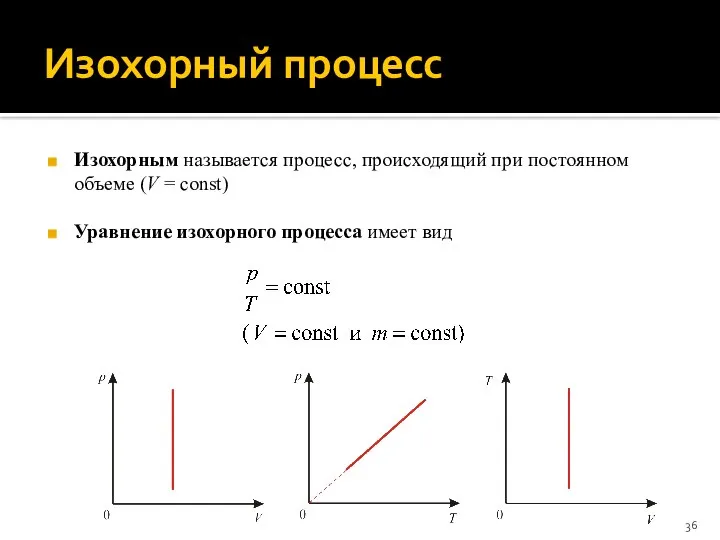
- 36. Изохорный процесс Изохорным называется процесс, происходящий при постоянном объеме (V = сonst) Уравнение изохорного процесса имеет
- 37. Изохорный процесс Работа идеального газа при изохорном процессе равна нулю (поскольку объем газа не изменяется): Уравнение
- 38. Изобарный процесс Изобарным называется процесс, происходящий при постоянном давлении (p= сonst) Уравнение изобарного процесса имеет вид
- 39. Изобарный процесс Работа идеального газа при изобарном процессе: Уравнение первого начала термодинамики для изобарного процесса сохраняет
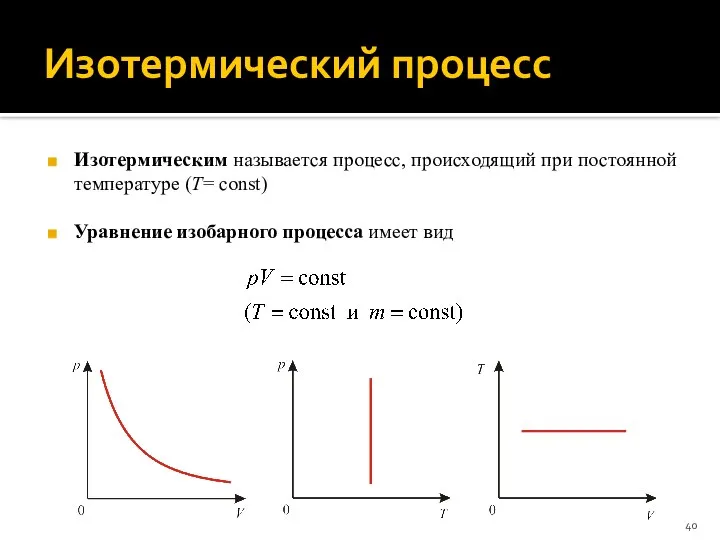
- 40. Изотермический процесс Изотермическим называется процесс, происходящий при постоянной температуре (T= сonst) Уравнение изобарного процесса имеет вид
- 41. Изотермический процесс Работа идеального газа при изотермическом процессе: Уравнение первого начала термодинамики для изотермического процесса: Теплоемкость
- 42. 3.7 Адиабатический процесс ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- 43. Адиабатический процесс Адиабатический процесс – это процесс, происходящий без теплообмена с окружающей средой (Q = 0).
- 44. Вывод уравнения адиабатического процесса Получим уравнение адиабатического процесса, рассмотрев уравнение Менделеева – Клапейрона и уравнение первого
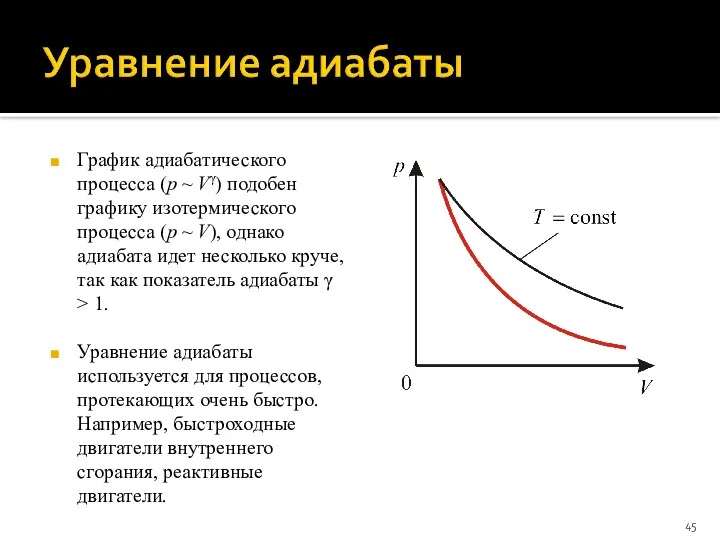
- 45. График адиабатического процесса (p ~ Vγ) подобен графику изотермического процесса (p ~ V), однако адиабата идет
- 46. Уравнение адиабаты Выражая из уравнения Менделеева – Клапейрона давление p, получим уравнение адиабаты в переменных TV:
- 47. Работа и теплоемкость газа в адиабатическом процессе Для вычисления работы, совершаемой идеальным газом в адиабатическом процессе,
- 48. 3.8 Политропический процесс ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- 49. Политропический процесс Политропическим называется процесс, протекающий при постоянной теплоемкости (C = const, т.е. не зависит от
- 50. Теплоемкость при политропическом процессе Найдем теплоемкость при политропическом процессе. Согласно определению теплоемкости Рассмотрим уравнения Менделеева –
- 52. Скачать презентацию













































 Проблема описания новой области знания. Микромир
Проблема описания новой области знания. Микромир Собственные частоты и формы колебаний
Собственные частоты и формы колебаний Температура
Температура Прямолинейное равноускоренное движение. Методика решения задач по физике
Прямолинейное равноускоренное движение. Методика решения задач по физике Презентация по физике "Поверхностное натяжение жидкостей" - скачать
Презентация по физике "Поверхностное натяжение жидкостей" - скачать  спеціальна теорія відносності
спеціальна теорія відносності  Анализ ошибки по скорости
Анализ ошибки по скорости Фізика як природнича наука. Пізнання природи
Фізика як природнича наука. Пізнання природи Презентация по физике "Способы теплопередачи" - скачать бесплатно
Презентация по физике "Способы теплопередачи" - скачать бесплатно ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Аттестационная работа. Проект «Клуб юных физиков»
Аттестационная работа. Проект «Клуб юных физиков» Автор: ученица 4 класса «В» ГОУ ЦО № 1481 Пивоварова Анастасия Руководитель: Каландарова Е.В.
Автор: ученица 4 класса «В» ГОУ ЦО № 1481 Пивоварова Анастасия Руководитель: Каландарова Е.В. Фокусировка лазерного излучения
Фокусировка лазерного излучения Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Литр
Литр Переходная функция. Импульсная характеристика. ТАУ 2
Переходная функция. Импульсная характеристика. ТАУ 2 Электричество и магнетизм. Колебания и волны
Электричество и магнетизм. Колебания и волны Сплавы металлов
Сплавы металлов Лекция № 7. Колебательное движение
Лекция № 7. Колебательное движение Давление в жидкости и газе. Урок физики в 7 классе
Давление в жидкости и газе. Урок физики в 7 классе Пространство и время. Симметрия в физике
Пространство и время. Симметрия в физике Развитие электротехники: этапы, направления
Развитие электротехники: этапы, направления Цель урока. Изучить свойства звука: отражение, эхо. Отрабатывать навыки решения задач. Цель урока. Изучить свойства звука: отражени
Цель урока. Изучить свойства звука: отражение, эхо. Отрабатывать навыки решения задач. Цель урока. Изучить свойства звука: отражени Сцепление. Привод сцепления
Сцепление. Привод сцепления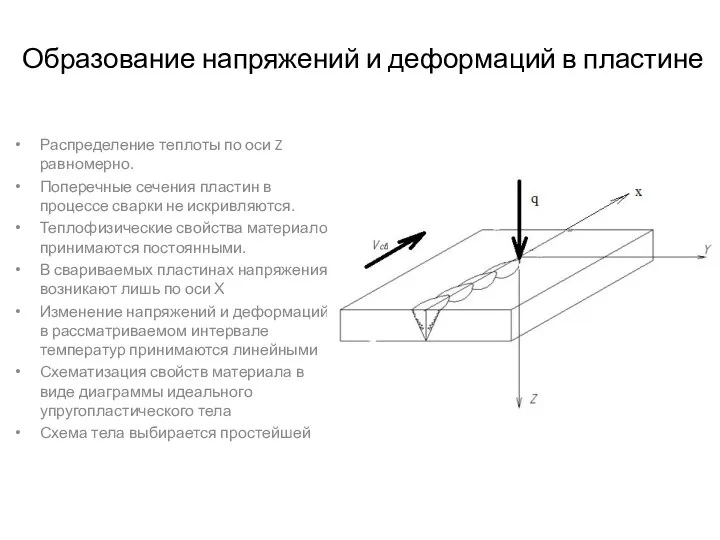 Образование напряжений и деформаций в пластине
Образование напряжений и деформаций в пластине Изобретение радио А.С. Поповым
Изобретение радио А.С. Поповым Сила упругости. Закон Гука
Сила упругости. Закон Гука Презентация по физике "Основное уравнение МКТ" - скачать
Презентация по физике "Основное уравнение МКТ" - скачать