Содержание
- 2. Тончайший мономолекулярный слой, расположенный на границе раздела двух фаз, накапливает огромный запас свободной поверхностной энергии (Gs).
- 3. Поверхностное натяжение, адсорбция, адгезия и другие процессы, протекающие на границе раздела двух фаз, называются поверхностными явлениями.
- 4. Они осуществляются самопроизвольно за счет свободной поверхностной энергии.
- 5. Поверхностные явления играют важную роль в дыхании, пищеварении, экскреции.
- 6. Они протекают in vivo на развитых поверхностях раздела: поверхность кожи – 1,5 м2 эритроцитов – 3000
- 7. План 15.1 Поверхностная энергия и поверхностное натяжение 15.2 Адсорбция и ее виды 15.3 Адсорбция на границе
- 8. 15.1Энергетическое состояние молекул вещества в межфазном поверхностном слое и в глубине фазы различно.
- 9. Рассмотрим состояние молекул в однокомпонентной двухфазной системе: вода – водяной пар.
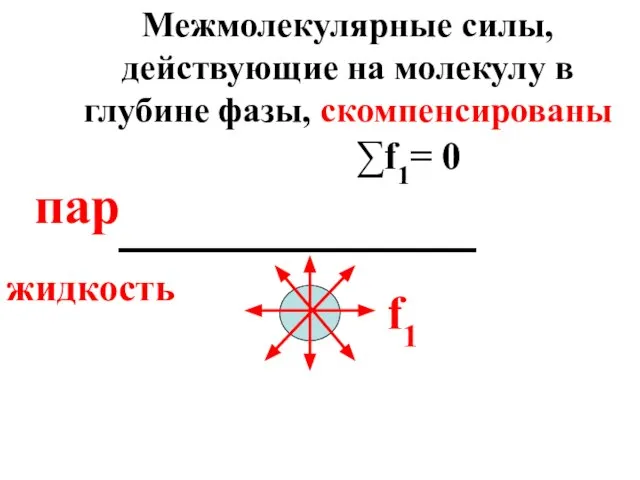
- 10. На молекулу воды, находящуюся в глубине фазы, действуют силы межмолекулярного взаимодействия (f1), причем их равнодействующая равна
- 11. f1 пар жидкость ∑f1= 0 Межмолекулярные силы, действующие на молекулу в глубине фазы, скомпенсированы
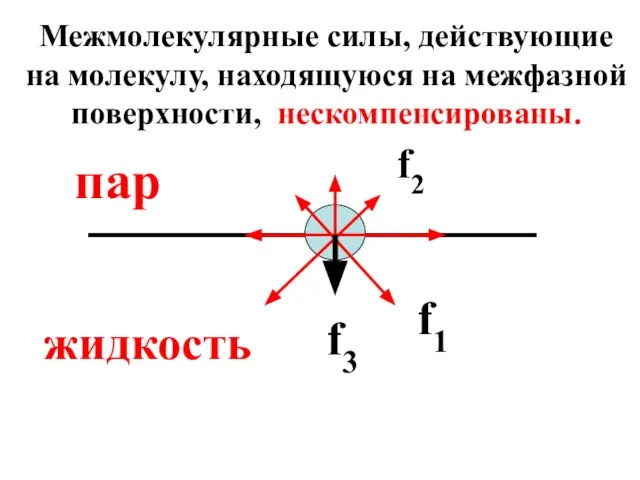
- 12. Молекула на границе раздела фаз в большей степени испытывает действие межмолекулярных сил со стороны жидкой фазы
- 13. f2 f1 f3 пар жидкость Межмолекулярные силы, действующие на молекулу, находящуюся на межфазной поверхности, нескомпенсированы.
- 14. Сила f3 создает внутреннее (межмолекулярное) давление жидкости, которое для воды составляет 14 000 атм/см2. Межмолекулярное давление-это
- 15. Вследствие нескомпенсированности сил межмолекулярного взаимодействия, поверхностный слой имеет избыточную свободную энергию (по сравнению с объемом жидкости):
- 16. где S – площадь поверхности раздела фаз, м2 σ – коэффициент пропорциональности, называемый поверхностным натяжением.
- 17. Gs Дж Н σ = , = S м2 м Поверхностное натяжение – это поверхностная энергия
- 18. Поверхностное натяжение – важная характеристика жидкостей; оно зависит а) от температуры, б) от полярности среды.
- 19. С увеличением температуры поверхностное натяжение жидкостей уменьшается, т.к. разрывается часть связей межмолекулярного взаимодействия.
- 20. Чем выше полярность жидкости, тем больше ее поверхностное натяжение, т.к. с увеличением полярности возрастают силы межмолекулярного
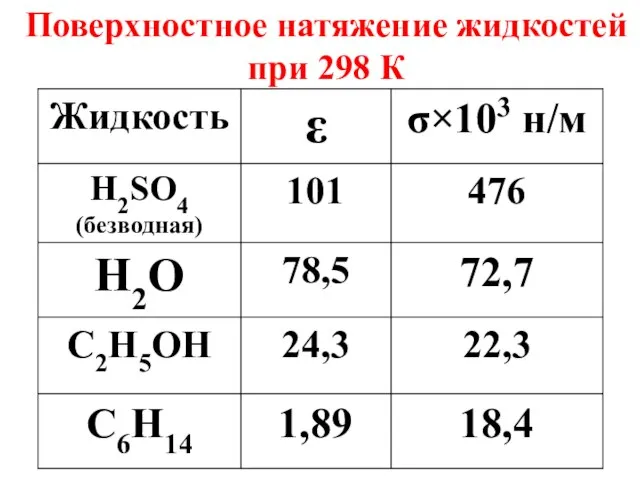
- 21. Поверхностное натяжение жидкостей при 298 К
- 22. Поверхностное натяжение – важная характеристика биологических жидкостей. В норме σ крови равно 45,4×10-3 н/м.
- 23. Измерение поверхностного натяжения крови - важный диагностический тест.
- 24. Изменения σ сыворотки крови свидетельствует о наличии онкологических заболеваний, анафилактическом шоке и других заболеваниях. Кроме того,
- 25. Наиболее принятым методом определения поверхностного натяжения является сталогмометрический метод.
- 26. Согласно второму закону термодинамики Gs → min. Это стремление реализуется: а) за счет уменьшения площади поверхности
- 27. б) за счет адсорбции, т.к. при адсорбции уменьшается поверхностное натяжение жидкостей.
- 28. 15.2. Адсорбцией называется концентрирование какого-либо вещества в поверхностном слое в результате самопроизвольного перехода его из объема
- 29. Активирован-ный уголь Молекулы газа
- 30. При адсорбции различают два понятия: Адсорбент, Адсорбат.
- 31. Адсорбент – вещество, на поверхности которого идет адсорбция. Адсорбат – вещество, которое концентрируется на поверхности адсорбента.
- 32. Адсорбция (Г) выражается в г/м2 или моль/м2 и рассчитывается по формулам: Г = ν S m
- 33. В зависимости от природы сил, действующих между адсорбентом и адсорбатом, различают физическую и химическую адсорбцию.
- 34. Физическая адсорбция обусловлена межмолекулярным взаимодействием (силы Ван-дер-Ваальса). Энергия этих взаимодействий невелика и составляет ~4-40 кДж/моль.
- 35. Для физической адсорбции характерны: обратимость: одновременно с адсорбцией протекает десорбция, неспецифичность: она подчиняется правилу «подобное растворяется
- 36. В соответствии с принципом Ле Шателье, протеканию физической адсорбции способствует: понижение температуры, увеличение концентрации адсорбата, повышение
- 37. Химическая адсорбция (хемосорбция) осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической (ковалентной) связи.
- 38. Энергия связи при хемосорбции составляет 40-400 кДж/моль, что делает ее практически необратимой, специфичной и локализованной.
- 39. Повышение температуры усиливает хемосорбцию, что приводит к большому связыванию адсорбата.
- 40. По характеру межфазной поверхности различают адсорбцию, протекающую на границе раздела: А) жидкость/газ, Б) жидкость/жидкость, В) твердое
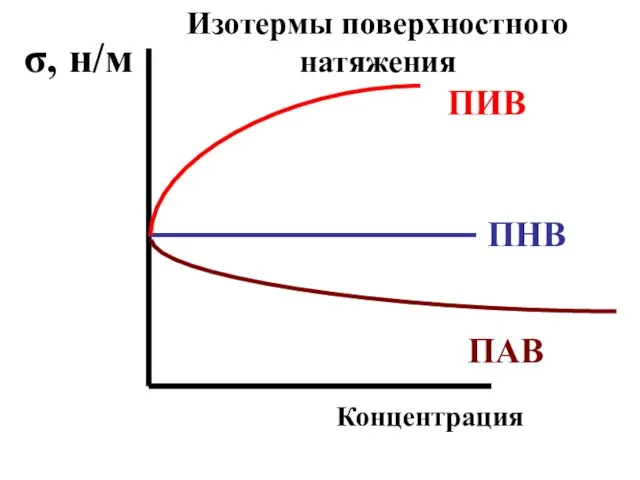
- 41. 15.3 При растворении в воде какого-либо вещества может наблюдаться: А) понижение ее поверхностного натяжения. Такие вещества
- 42. Б) повышение ее поверхностного натяжения. Такие вещества называются поверхностно-инактивными (ПИВ); к ним относятся неорганические кислоты, основания
- 43. В) поверхностное натяжение жидкости не изменяется. Такие вещества называются поверхностно-неактивными (ПНВ). К ним относятся глюкоза, сахароза
- 44. ПИВ ПНВ ПАВ σ, н/м Концентрация Изотермы поверхностного натяжения
- 45. Поверхностно-активными (ПАВ) называются вещества, уменьшающие поверхностное натяжение жидкостей.
- 46. Их молекулы дифильны и ассиметричны; они состоят из неполярного гидрофобного радикала и полярной гидрофильной группы:
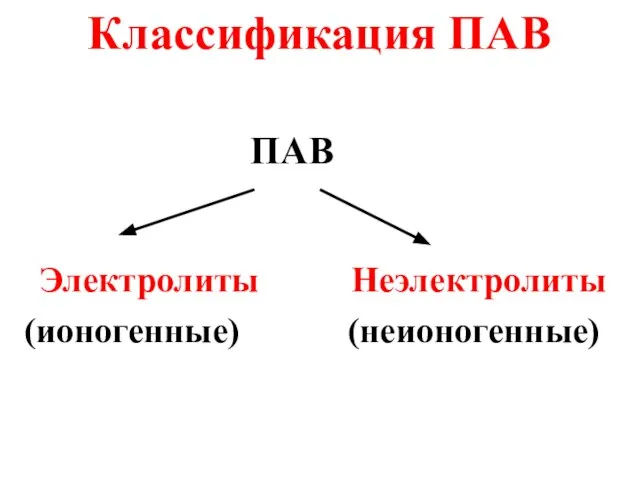
- 47. Классификация ПАВ ПАВ Электролиты Неэлектролиты (ионогенные) (неионогенные)
- 48. Ионогенные ПАВ делятся на: Катионоактивные: Соли и гидроксиды алкиламмония
- 49. Например, цетилтриметил аммоний бромид, используемый как антисептик [CH3- (CH2)15N (CH3)3]Br
- 50. 2) Аниононоактивные: Соли карбоновых кислот R-COOMe, Соли сульфокислот R-SO3Me
- 51. К неионогенным ПАВ относятся: Карбоновые кислоты R-COOH, Сульфокислоты R - SO3H, Спирты R - OH, Тиолы
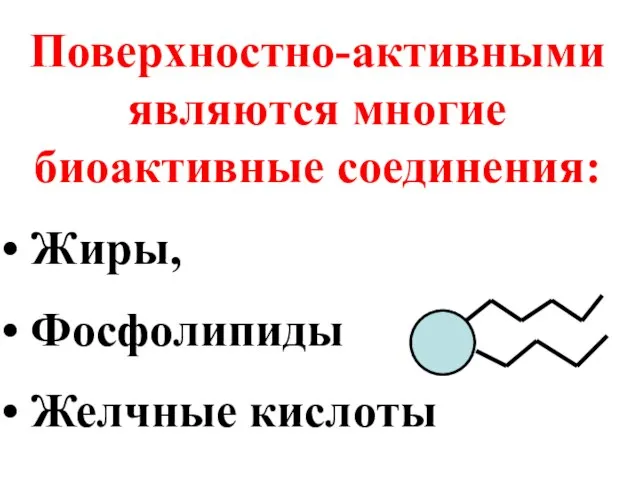
- 52. Поверхностно-активными являются многие биоактивные соединения: Жиры, Фосфолипиды Желчные кислоты
- 53. В соответствии с правилом «Подобное стремится к подобному», гидрофобные радикалы направлены в неполярную фазу (воздух), а
- 54. Насыщен-ный слой Ненасыщен-ный слой «частокол Ленгмюра» Адсорбция ПАВ на границе жидкость-газ
- 55. Поскольку молекулы ПАВ менее полярны, чем молекулы воды, силы поверхностного натяжения в поверхностном слое уменьшаются.
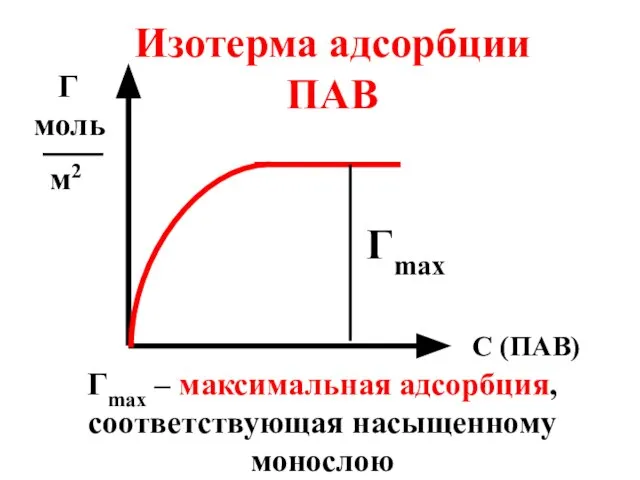
- 56. С (ПАВ) Г моль м2 Изотерма адсорбции ПАВ Гmax Гmax – максимальная адсорбция, соответствующая насыщенному монослою
- 57. Зная Гmax можно рассчитать а) длину молекулы ПАВ (ℓ) ℓ = Г max M ρ ρ
- 58. б) площадь, занимаемую молекулой ПАВ на границе раздела фаз (s): s = 1 Г max NA
- 59. Важнейшей характеристикой ПАВ является их поверхностная активность (g): g = Δσ ΔC где Δσ – уменьшение
- 60. Правило Дюкло-Траубе (1888): с увеличением длины гидрофобного радикала на группу -CH2- поверхностная активность ПАВ возрастает в
- 61. Правило выполняется для членов одного гомологического ряда: спиртов, аминов, карбоновых кислот и т.д.
- 62. Сn Сn+1 Сn+2 C ПАВ σ, Н м Семейство изотерм поверхностного натяжения гомологов
- 63. Семейство изотерм адсорбции гомологов С ПАВ Г моль м2 Сn+2 Сn+1 Сn
- 64. Зависимость адсорбции ПАВ от их концентрации в растворе описывается уравнением Гиббса (1878): Г = dσ dс
- 65. Влияние концентрации ПАВ на поверхностное натяжение растворов описывается уравнением Шишковского (1909): σ = σо – а
- 66. Для расчета адсорбции ПАВ используется объединенное уравнение Гиббса-Шишковского: Г = a RT b×c 1 + b×c
- 67. Применение ПАВ Как моющие средства: молекулы ПАВ адсорбируются на поверхности жирного пятна, образуя гидрофильную систему, хорошо
- 68. Жир
- 69. 2) Как антисептики в хирургии: антимикробная активность ионогенных ПАВ значительно выше (до 300 раз) активности традиционно
- 70. Обеззараживающее действие ПАВ объясняют их влиянием на проницаемость клеточных мембран микроорганизмов, а также ингибирующим действием на
- 71. 3) Для производства липосом Липосома (греч. «липос» - жир, «сома» - тело) – это надмолекулярная структура,
- 73. Липосомы применяются для направленной доставки лекарственного препарата к пораженным органам и тканям.
- 74. Липосомы могут переносить широкий круг фармакологически активных веществ: противоопухолевые и противомикробные препараты, гормоны, ферменты, вакцины, а
- 75. При этом препарат не отравляет здоровые ткани человека.
- 76. Как носители лекарств, наиболее широкое применение липосомы получили в онкологии и пульмонологии (лечение туберкулеза), т.е. в
- 78. Скачать презентацию










































![Например, цетилтриметил аммоний бромид, используемый как антисептик [CH3- (CH2)15N (CH3)3]Br](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/549862/slide-48.jpg)

























 Презентация Энергосберегающие лампы.
Презентация Энергосберегающие лампы. Физические величины. Измерение физических величин. Точность и погрешность измерения
Физические величины. Измерение физических величин. Точность и погрешность измерения Силы давления в жидкой и газообразной средах
Силы давления в жидкой и газообразной средах Импульс, энергия, законы сохранения. Решение задач
Импульс, энергия, законы сохранения. Решение задач Бурильные трубы
Бурильные трубы Презентация по физике "Воздухоплавание" - скачать бесплатно
Презентация по физике "Воздухоплавание" - скачать бесплатно PowerPoint Template
PowerPoint Template Свободное падение Свободным падением называется движение тел под действием силы тяжести.
Свободное падение Свободным падением называется движение тел под действием силы тяжести. Сцепление. Привод сцепления
Сцепление. Привод сцепления Урок контроля знаний по физике «Мы изучили электричество» Учитель высшей категории МБОУ СОШ №21 Николаева О.И.
Урок контроля знаний по физике «Мы изучили электричество» Учитель высшей категории МБОУ СОШ №21 Николаева О.И. Оптический телескоп
Оптический телескоп Тезисы. Естественное освещение. КЕО
Тезисы. Естественное освещение. КЕО лекция №4 для студентов 1 курса, обучающихся по специальности 060201 - Стоматология К.п.н., доцент Шилина Н.Г. Красноярск, 2012 Тема:
лекция №4 для студентов 1 курса, обучающихся по специальности 060201 - Стоматология К.п.н., доцент Шилина Н.Г. Красноярск, 2012 Тема:  Учение о свете - оптика
Учение о свете - оптика Электр аккумуляторы
Электр аккумуляторы Второй закон термодинамики. Энтропия. (Лекция 3)
Второй закон термодинамики. Энтропия. (Лекция 3) Динамика жидкости и газа с учетом температуры
Динамика жидкости и газа с учетом температуры Синергетика и ее основные положения
Синергетика и ее основные положения Валентность
Валентность ИК-спектроскопия. Электромагнитный спектр
ИК-спектроскопия. Электромагнитный спектр Электротехника и электроника. Трехфазные электрические цепи. (Лекция 8)
Электротехника и электроника. Трехфазные электрические цепи. (Лекция 8) Цепная ядерная реакция. Ядерный реактор. АЭС
Цепная ядерная реакция. Ядерный реактор. АЭС Электромагнитные волны (продолжение)
Электромагнитные волны (продолжение) Электромагнитное поле
Электромагнитное поле Турбодвигатель TSI
Турбодвигатель TSI Электростатика
Электростатика Quantum computing
Quantum computing Организация мониторинга показателей качества электрической энергии
Организация мониторинга показателей качества электрической энергии