Содержание
- 2. Учебная литература Курс физической химии: В 2-х т. Т 1./ Под ред. Я.И. Герасимова. Изд. 2.
- 3. Методическая и справочная литература Краткий справочник физико-химических величин / Под ред. А.А. Равделя, А.М. Пономаревой- СПб.:
- 4. Физическая химия (ФХ) – наука о применении теоретических и экспериментальных методов физики для решения химических проблем.
- 5. Основные разделы ФХ Химическая термодинамика (ХТД) На основе всеобщих термодинамических законов рассматривает особенности тепло- и массообмена
- 6. Химическая термодинамика Основные понятия химической термодинамики
- 7. ХТД изучает взаимные превращения массы и энергии (в форме теплоты и работы) при протекании химических реакций.
- 9. Состояние ТДС описывают при помощи термодинамических переменных.
- 10. Свойства функций состояния и функций процесса Бесконечно малое изменение функции состояния есть полный дифференциал dF. Изменение
- 11. Теплота и работа – два способа передачи энергии. Теплота – энергия передается за счет хаотического движения
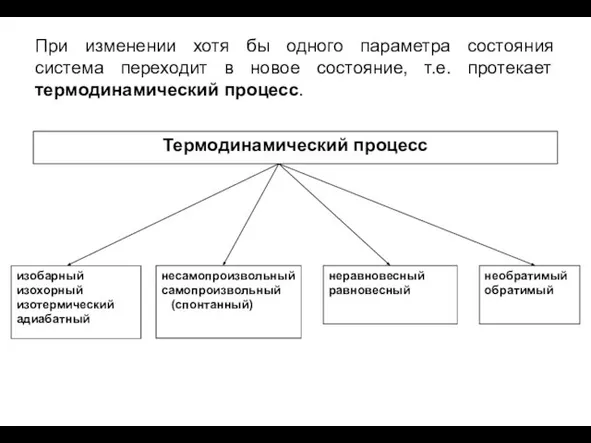
- 12. При изменении хотя бы одного параметра состояния система переходит в новое состояние, т.е. протекает термодинамический процесс.
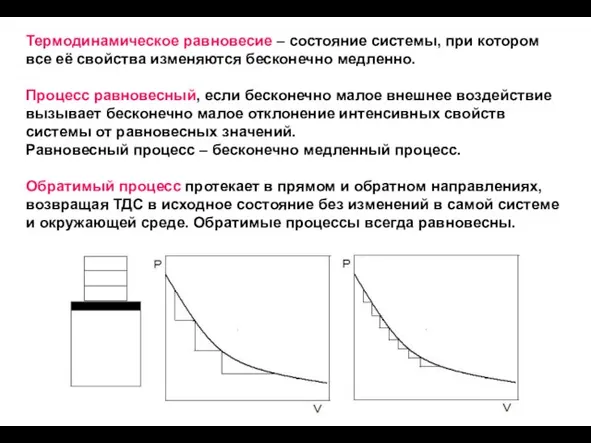
- 13. Термодинамическое равновесие – состояние системы, при котором все её свойства изменяются бесконечно медленно. Процесс равновесный, если
- 14. Первое начало термодинамики I закон термодинамики - закон сохранения энергии для тепловых процессов, в которых энергия
- 15. dU = δq – δA − дифференциальная форма (1) ∆U = q – A − интегральная
- 16. Теплота и работа в различных процессах dU = δQ – PdV (5)
- 17. dU = δQ – PdV (5)
- 18. dU = δQ – PdV (5)
- 19. dU = δQ – PdV (5)
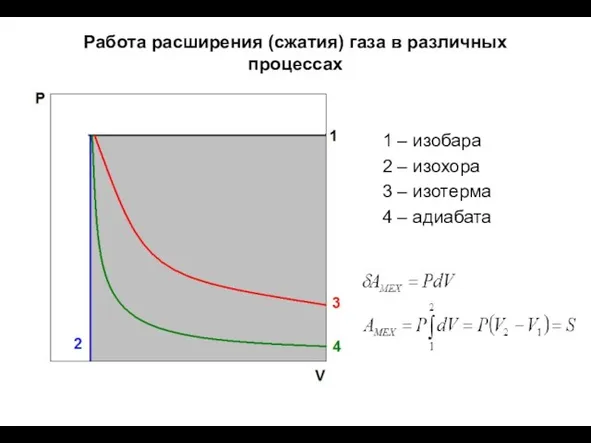
- 20. Работа расширения (сжатия) газа в различных процессах 1 – изобара 2 – изохора 3 – изотерма
- 21. Разминка В процессе дыхания при расширении и сжатии легких человек затрачивает энергию. Каждый выдох из легких
- 23. Скачать презентацию

















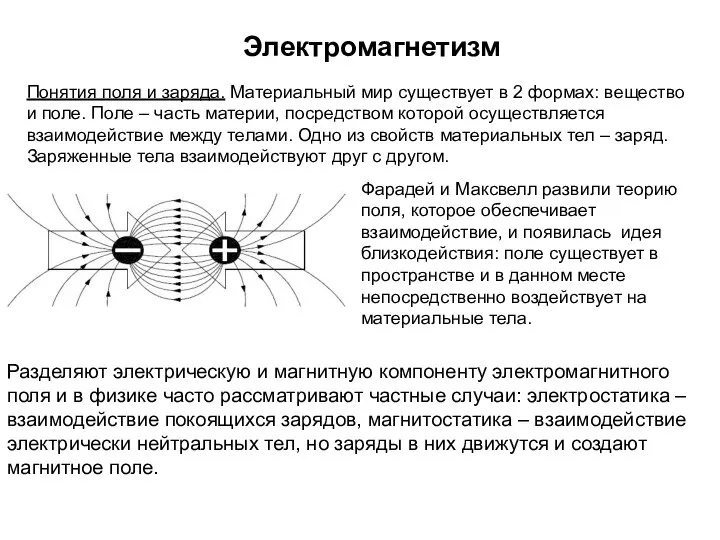 Электромагнетизм. Понятия поля и заряда
Электромагнетизм. Понятия поля и заряда Презентация по физике "Знатоки физики и техники" - скачать
Презентация по физике "Знатоки физики и техники" - скачать  Основные понятия и определения современных систем управления движением судов
Основные понятия и определения современных систем управления движением судов Техническая механика
Техническая механика Проект выполняли: ученики 7 «А» класса Бикмурзин Рауф Ренатович и Щелкунов Глеб Владиленович Дата рождения : 07.10.98 Дата рожд
Проект выполняли: ученики 7 «А» класса Бикмурзин Рауф Ренатович и Щелкунов Глеб Владиленович Дата рождения : 07.10.98 Дата рожд Benefits and risks of artificial intelligence
Benefits and risks of artificial intelligence Закон сохранения импульса
Закон сохранения импульса Источник тока. ЭДС, способы ее измерения. Закон Ома для замкнутой цепи
Источник тока. ЭДС, способы ее измерения. Закон Ома для замкнутой цепи Движение в неинерциальных системах отсчёта
Движение в неинерциальных системах отсчёта Скло
Скло Вес тела 7 класс
Вес тела 7 класс Основные законы магнитного поля: теорема Гаусса и теорема о циркуляции индукции магнитного поля
Основные законы магнитного поля: теорема Гаусса и теорема о циркуляции индукции магнитного поля Развитие средств связи
Развитие средств связи Что изучает физика
Что изучает физика Жартылай өткізгіштер
Жартылай өткізгіштер Аттестационная работа. Физический кружок (эссе из опыта работы). Овладение комплексом физических знаний
Аттестационная работа. Физический кружок (эссе из опыта работы). Овладение комплексом физических знаний Поширення електромагнітних хвиль над пласкою ідеально провідною поверхнею
Поширення електромагнітних хвиль над пласкою ідеально провідною поверхнею Идеальный газ в МКТ
Идеальный газ в МКТ Контрольно-измерительные приборы
Контрольно-измерительные приборы Испарение и конденсация. Кипение жидкости Подготовка к ГИА Учитель: Попова И.А. МОУ СОШ № 30 г. Белово Белово 2010
Испарение и конденсация. Кипение жидкости Подготовка к ГИА Учитель: Попова И.А. МОУ СОШ № 30 г. Белово Белово 2010  Коэффициент полезного действия теплового двигателя
Коэффициент полезного действия теплового двигателя Гидродинамика идеальной жидкости
Гидродинамика идеальной жидкости Элементы теории упругости. Гидродинамика
Элементы теории упругости. Гидродинамика Физика пәнінің электро-монтер мамандығында алатын орны
Физика пәнінің электро-монтер мамандығында алатын орны Измеряем площадь взвешиванием
Измеряем площадь взвешиванием Наблюдение гравитационных волн в эксперименте LIGO
Наблюдение гравитационных волн в эксперименте LIGO Реализация проекта строительства атомной электростанции в Республике Беларусь
Реализация проекта строительства атомной электростанции в Республике Беларусь Корпускулярно-волновой дуализм света
Корпускулярно-волновой дуализм света