Содержание
- 2. @ Краснополянская школа № 1 Домнин Константин Михайлович 2006 год Электрический ток в различных средах Электрический
- 3. ВОПРОСЫ: Электролитическая диссоциация Электрический ток в электролитах. Электролиз Законы электролиза Применение электролиза
- 4. Электролитическая диссоциация Вопрос 1
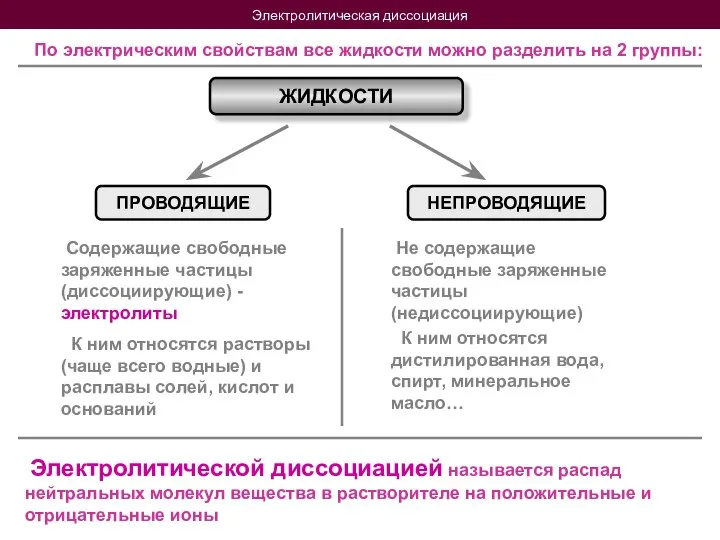
- 5. Электролитическая диссоциация По электрическим свойствам все жидкости можно разделить на 2 группы: ЖИДКОСТИ ПРОВОДЯЩИЕ НЕПРОВОДЯЩИЕ Содержащие
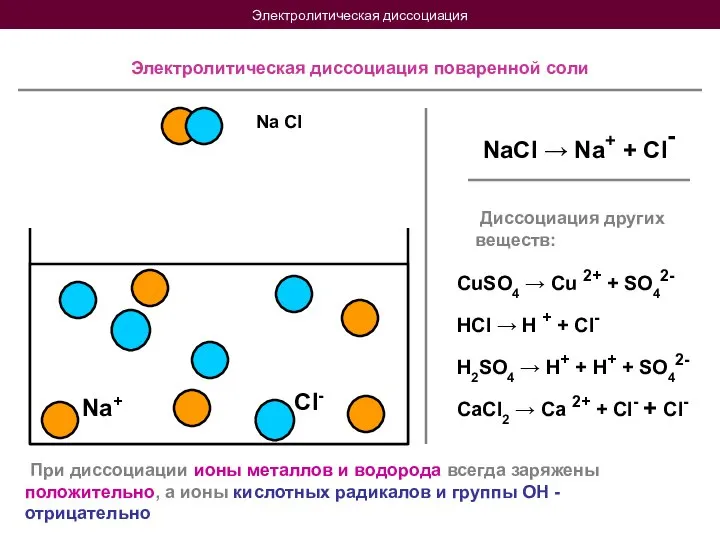
- 6. Электролитическая диссоциация Na Cl Na+ Cl- Электролитическая диссоциация поваренной соли NaCl → Na+ + Cl- Диссоциация
- 7. Электрический ток в электролитах. Электролиз Вопрос 2
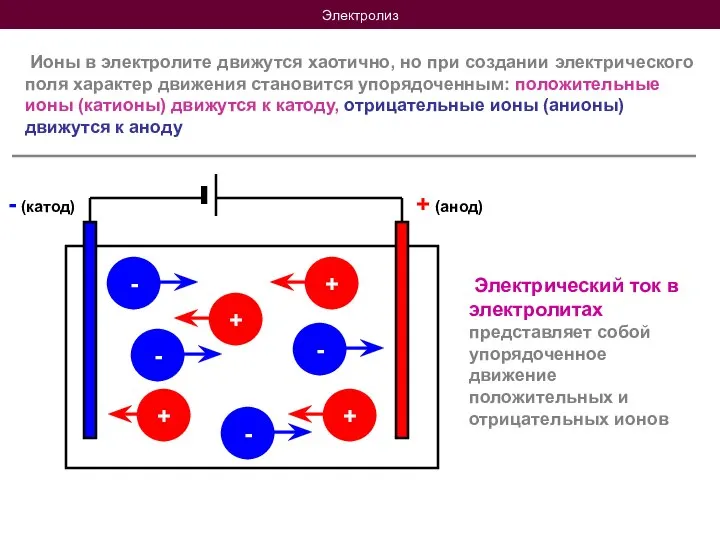
- 8. Электролиз Ионы в электролите движутся хаотично, но при создании электрического поля характер движения становится упорядоченным: положительные
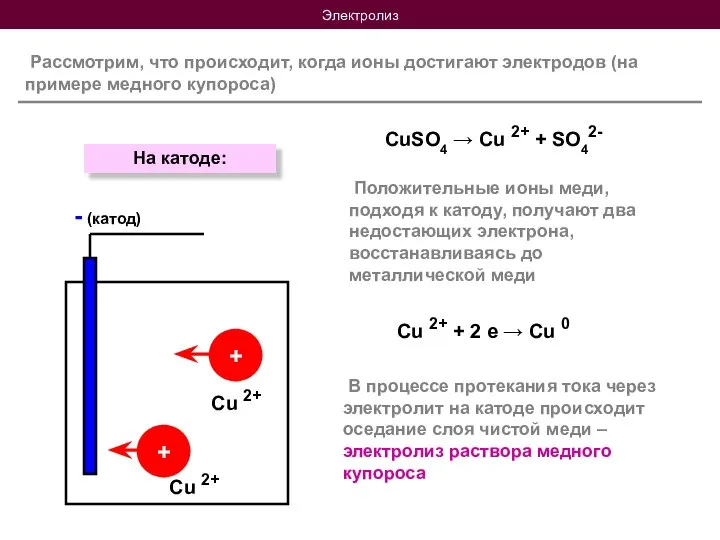
- 9. Электролиз Рассмотрим, что происходит, когда ионы достигают электродов (на примере медного купороса) CuSO4 → Cu 2+
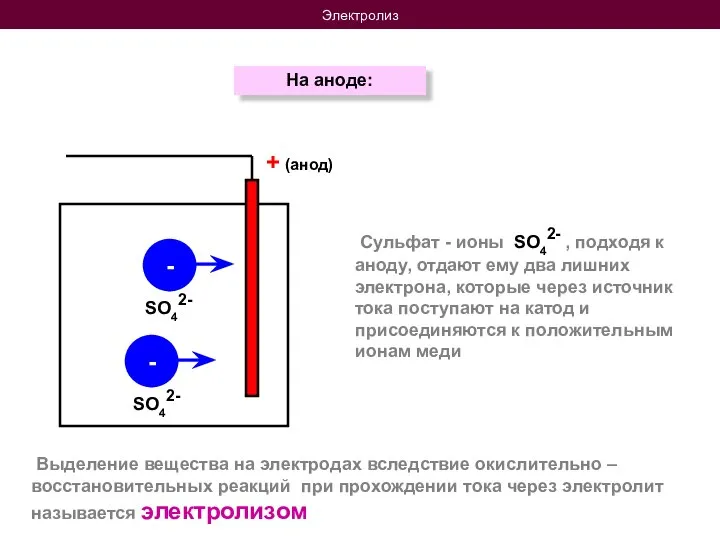
- 10. Электролиз На аноде: + (анод) - - Выделение вещества на электродах вследствие окислительно – восстановительных реакций
- 11. Законы электролиза Вопрос 3
- 12. Законы электролиза Исследовал электролиз и открыл его законы английский физик Майкл Фарадей в 1834 году Майкл
- 13. Законы электролиза Второй закон электролиза При одинаковом количестве электричества (электрическом заряде, прошедшем через электролит) масса вещества,
- 14. Применение электролиза Вопрос 4
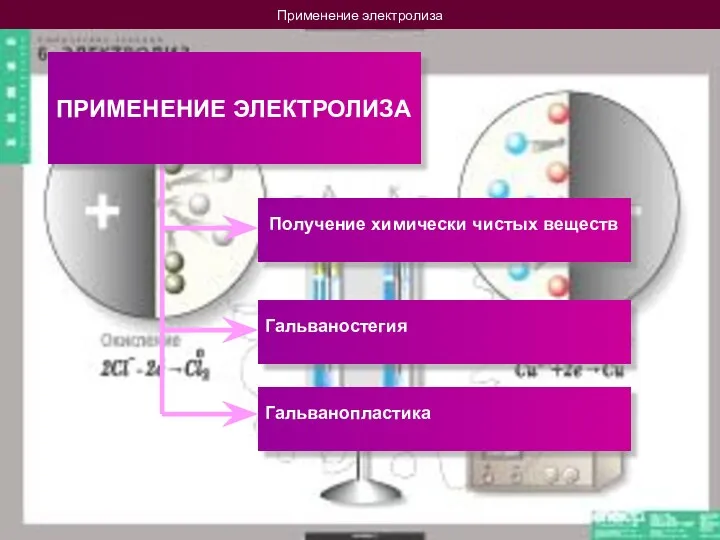
- 15. Применение электролиза ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА Получение химически чистых веществ Гальваностегия Гальванопластика
- 16. Применение электролиза Основателем гальванотехники и ее широчайшего применения является Б. С. Якоби, который изобрел в 1836
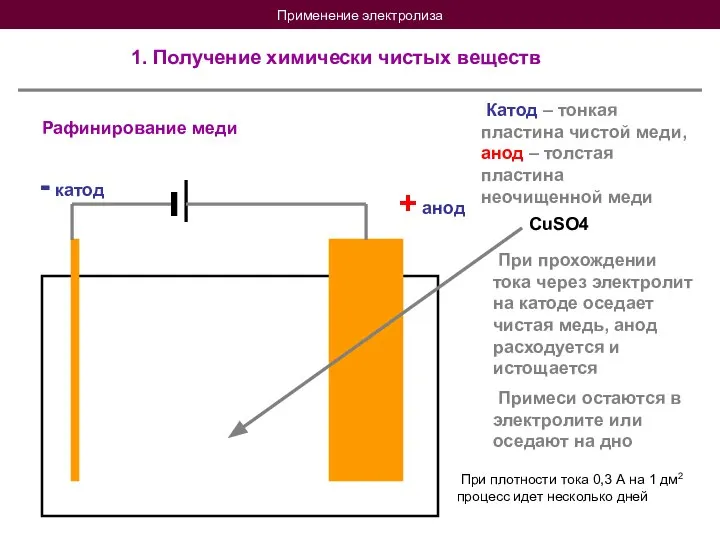
- 17. Применение электролиза 1. Получение химически чистых веществ Рафинирование меди + анод - катод Катод – тонкая
- 18. Применение электролиза 1. Получение химически чистых веществ Получение алюминия Алюминий получают электролитическим способом из глинозема (вспомните
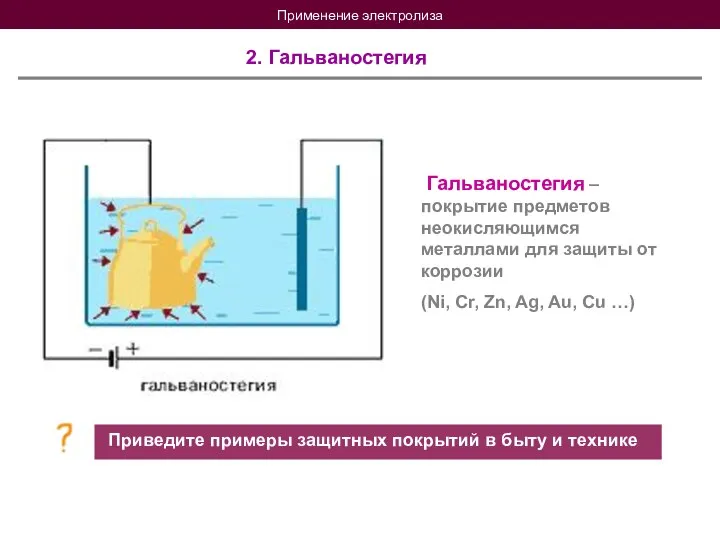
- 19. Применение электролиза 2. Гальваностегия Гальваностегия – покрытие предметов неокисляющимся металлами для защиты от коррозии (Ni, Cr,
- 20. Применение электролиза 3. Гальванопластика Копия барельефа, полученная методом гальванопластики Гальванопластика – получение отслаиваемых копий предмета, полученных
- 21. Применение электролиза Кроме указанных выше, электролиз нашел применение и в других областях: получение оксидных защитных пленок
- 23. Скачать презентацию












 Ход лучей в линзах и сферических зеркалах
Ход лучей в линзах и сферических зеркалах Коробка передач. Основное устройство и принцип работы
Коробка передач. Основное устройство и принцип работы Гипотеза де Бройля. Комптоновская длина волны и длина волны де Бройля
Гипотеза де Бройля. Комптоновская длина волны и длина волны де Бройля Динамика. Инерциальные системы отсчета. Первый закон Ньютона
Динамика. Инерциальные системы отсчета. Первый закон Ньютона Пара сил. Основная теорема статики
Пара сил. Основная теорема статики Енергозбереження в побуті
Енергозбереження в побуті Радиоактивные излучения. Радиоактивность. Закон радиоактивного распада
Радиоактивные излучения. Радиоактивность. Закон радиоактивного распада Количество теплоты. Удельная теплоёмкость
Количество теплоты. Удельная теплоёмкость Виды самоходной техники в АПК
Виды самоходной техники в АПК Термический каротаж. Внешние источники тепла. Излучение Солнца, звезд и галактик
Термический каротаж. Внешние источники тепла. Излучение Солнца, звезд и галактик Источники звука. Характеристики звука
Источники звука. Характеристики звука Момент силы относительно центра (точки)
Момент силы относительно центра (точки) Термометры и их виды
Термометры и их виды Выполнили:11 «А» Шафоростова Ольга Пирожкова Вероника. Руководитель: Бредгауэр Вера Александровна
Выполнили:11 «А» Шафоростова Ольга Пирожкова Вероника. Руководитель: Бредгауэр Вера Александровна Разработка ЖРД третьей ступени с дожиганием генераторного газа
Разработка ЖРД третьей ступени с дожиганием генераторного газа Теорема о циркуляции вектора магнитной индукции. (Лекция 14)
Теорема о циркуляции вектора магнитной индукции. (Лекция 14) Термодинаміка. Внутрішня енергія
Термодинаміка. Внутрішня енергія Электроемкость
Электроемкость МОУ «СОШ № 30 г.Белово»
МОУ «СОШ № 30 г.Белово» Механика материалов
Механика материалов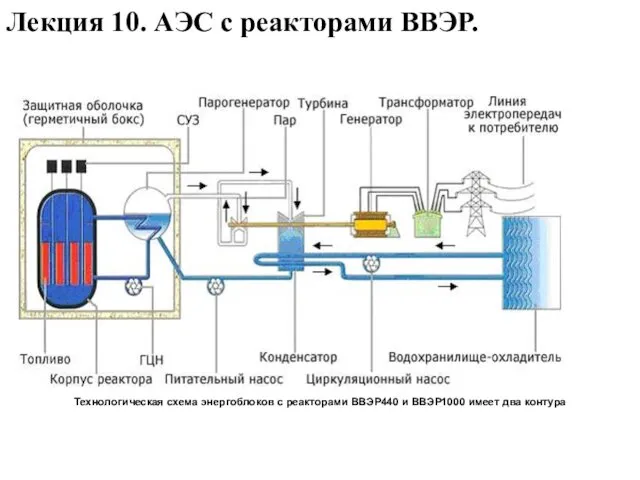 АЭС с реакторами ВВЭР
АЭС с реакторами ВВЭР Автоматизация процесса регулировки манометров
Автоматизация процесса регулировки манометров Презентация по физике "Свойства электромагнитных волн" - скачать бесплатно
Презентация по физике "Свойства электромагнитных волн" - скачать бесплатно Номинация «Научные исследования в области энергосберегающих технологий» ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ ЭФФЕКТИВНОСТИ РАБОТЫ ГОРЕ
Номинация «Научные исследования в области энергосберегающих технологий» ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ ЭФФЕКТИВНОСТИ РАБОТЫ ГОРЕ Воздействие электрического тока на человека
Воздействие электрического тока на человека Основы биореологии и гемодинамики. (Лекция 4)
Основы биореологии и гемодинамики. (Лекция 4) Свойство и принцип действия генератора переменного тока
Свойство и принцип действия генератора переменного тока Решение задач. Силы тяжести, упругости
Решение задач. Силы тяжести, упругости