До провідників належать розплави і розчини електролітів: кислот, лугів і солей.
Рідкими напівпровідниками є розплавлений селен, розплави сульфідів та ін.
Під час розчинення електролітів під впливом електричного поля полярних молекул води відбувається розпад молекул електролітів на іони. Цей процес називають електролітичною дисоціацією, в результаті якої нейтральні молекули розпадаються на позитивні та негативні іони. В електроліті з'являються вільні носії зарядів і він починає проводити струм.
До провідників належать розплави і розчини електролітів: кислот, лугів і солей. Рідкими напівпровідниками є розплавлений селен, розплави сульфідів та ін.
Під час розчинення електролітів під впливом електричного поля полярних молекул води відбувається розпад молекул електролітів на іони. Цей процес називають електролітичною дисоціацією, в результаті якої нейтральні молекули розпадаються на позитивні та негативні іони. В електроліті з'являються вільні носії зарядів і він починає проводити струм.








 Твердая фаза и поровое пространство почв. Основная гидрофизическая характеристика
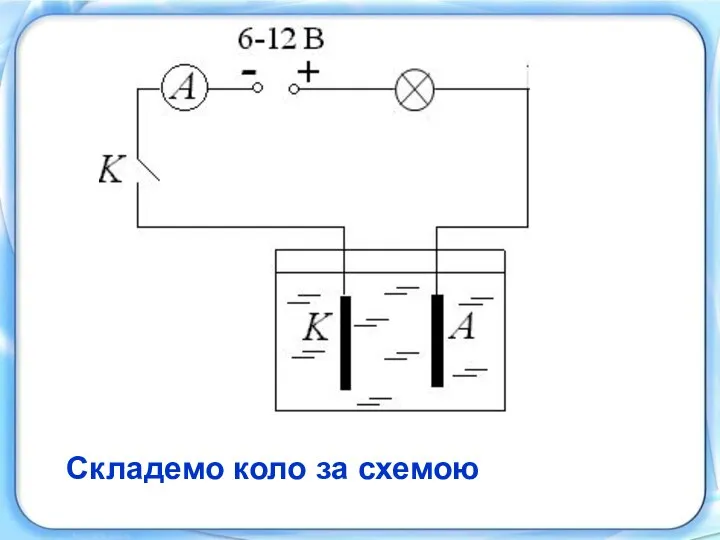
Твердая фаза и поровое пространство почв. Основная гидрофизическая характеристика Электрооборудование автомобилей. Системы электроснабжения. Аккумуляторные батареи. (Урок 2)
Электрооборудование автомобилей. Системы электроснабжения. Аккумуляторные батареи. (Урок 2) Волны де Бройля. Опыт Дэвиссона
Волны де Бройля. Опыт Дэвиссона Сила тока Работу выполнила: ученица 11 класса, Шабалина Елена.
Сила тока Работу выполнила: ученица 11 класса, Шабалина Елена.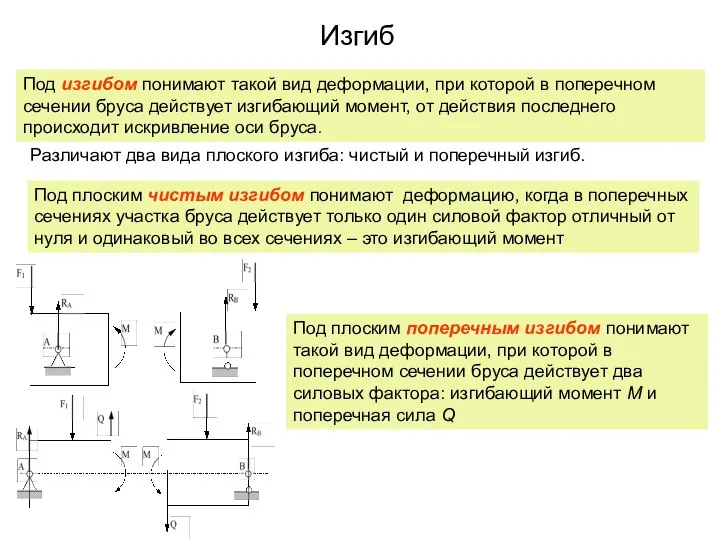 Изгиб
Изгиб МОУ Лестранхозовская СОШ
МОУ Лестранхозовская СОШ Нестационарная теплопередача через ограждающие конструкции. Теплоустойчивость
Нестационарная теплопередача через ограждающие конструкции. Теплоустойчивость Схема системы технического обслуживания и ремонта
Схема системы технического обслуживания и ремонта Техническая термодинамика. Первый закон термодинамики. (Лекция 2)
Техническая термодинамика. Первый закон термодинамики. (Лекция 2) Циклотрон
Циклотрон Тепло- и массообменные процессы, протекающие при производстве осушенного воздуха
Тепло- и массообменные процессы, протекающие при производстве осушенного воздуха Начало космической эры и роль ученых нашей страны в изучении вселенной
Начало космической эры и роль ученых нашей страны в изучении вселенной Парообразование. Пары. Влажность воздуха
Парообразование. Пары. Влажность воздуха 1.Кинетическая энергия – это энергия .. 2.Формула потенциальной энергии.. 3.Если V > в 3 раза, то кинетическая энергия… 4.Eполная=300Дж, Ек =170Дж, Еп=? 5.Какой энергией обладает катящийся по земле шар?
1.Кинетическая энергия – это энергия .. 2.Формула потенциальной энергии.. 3.Если V > в 3 раза, то кинетическая энергия… 4.Eполная=300Дж, Ек =170Дж, Еп=? 5.Какой энергией обладает катящийся по земле шар? Система питания топливом дизелей
Система питания топливом дизелей Контактные явления. Контакт металл - полупроводник
Контактные явления. Контакт металл - полупроводник Как обнаружили электричество
Как обнаружили электричество Оптичні ілюзії
Оптичні ілюзії Обработка экспериментальных данных. Часть 1
Обработка экспериментальных данных. Часть 1 Получение, передача и распределение энергии
Получение, передача и распределение энергии Джерела струму
Джерела струму История создания швейной машины
История создания швейной машины Лазеры и их применение
Лазеры и их применение Фотоны. Эффект Комптона
Фотоны. Эффект Комптона История отечественных космических ядерных установок
История отечественных космических ядерных установок Волновая функция, свойства волновой функции. Уравнение Шредингера. (Лекция 4)
Волновая функция, свойства волновой функции. Уравнение Шредингера. (Лекция 4) Электростатическое поле в вакууме
Электростатическое поле в вакууме Ток проводимости в металлах, его характеристики и условия существования
Ток проводимости в металлах, его характеристики и условия существования