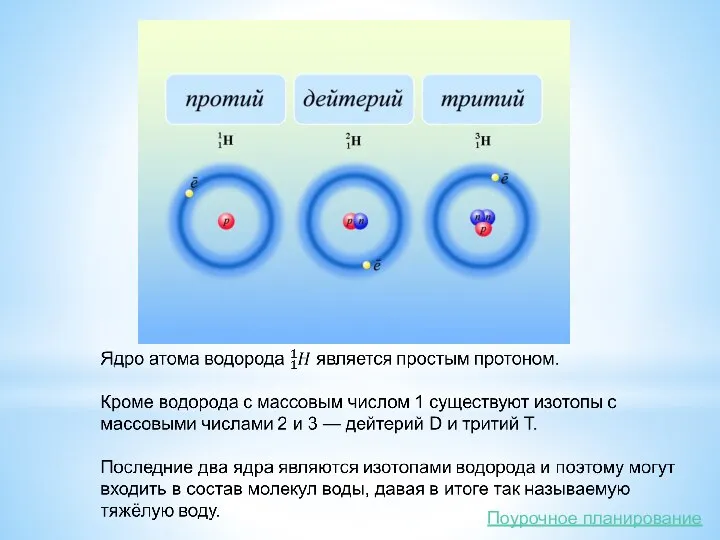
Атомное ядро
Атомное ядро заряжено положительно. Его диаметр не превышает 10–14–10–15 м,
а заряд Q равен произведению элементарного заряда электрона на порядковый номер атома Z в таблице Менделеева:
Q = Z·e.
В настоящее время доказано, что атомное ядро состоит из протонов и нейтронов, удерживаемых ядерными силами. Протоны и нейтроны носят общее название нуклонов.
Протон – это частица, заряд которой положителен и равен по модулю заряду электрона: qp = +1,6·10–19 Кл, а масса mp = 1,6726·10–27 кг.
Нейтрон – это нейтральная частица, масса которой равна mn = 1,6749·10–27 кг.
Условное обозначение химического элемента позволяет легко определять состав ядра и число электронов в атоме. В ядре атома кислорода 168О находятся 8 протонов и 8 нейтронов
Поурочное планирование










 Механические колебания. Характеристики колебательного движения
Механические колебания. Характеристики колебательного движения Понятие радиоактивности
Понятие радиоактивности Умная механика. Музыкальная шкатулка
Умная механика. Музыкальная шкатулка Сила терния
Сила терния Криогенные и сверхпроводящие электроэнергетические устройства (прикладная сверхпроводимость). Лекция 1
Криогенные и сверхпроводящие электроэнергетические устройства (прикладная сверхпроводимость). Лекция 1 Механическое движение
Механическое движение Многоэлектронные атомы. Взаимодействие атомов с излучением
Многоэлектронные атомы. Взаимодействие атомов с излучением Лекция 16 Тема: Равновесные состояния и процессы, их изображение на термодинамических диаграммах.
Лекция 16 Тема: Равновесные состояния и процессы, их изображение на термодинамических диаграммах.  Презентация по физике "Закон Ома" - скачать бесплатно
Презентация по физике "Закон Ома" - скачать бесплатно Для чего мы изучаем физику
Для чего мы изучаем физику Микроскоп – знакомство, создание, опыты
Микроскоп – знакомство, создание, опыты Popov Alexander Stepanovich
Popov Alexander Stepanovich Поверхностные явления. Образование мицелл. (Лекция 7)
Поверхностные явления. Образование мицелл. (Лекция 7) Оптические методы анализа
Оптические методы анализа Тесты. Изменение агрегатных состояний вещества
Тесты. Изменение агрегатных состояний вещества Оптика и атомная физика
Оптика и атомная физика Экспертные советы по теоретической физике
Экспертные советы по теоретической физике Моделирование распространения фотонов с помощью метода Монте-Карло
Моделирование распространения фотонов с помощью метода Монте-Карло Презентация по физике "Одинокие атомы" - скачать
Презентация по физике "Одинокие атомы" - скачать  Spacex tesla
Spacex tesla Презентация по физике "Напряжение" - скачать
Презентация по физике "Напряжение" - скачать  Исследование термодинамических свойств термосов
Исследование термодинамических свойств термосов Лапласа Пьера Симона: «То, что мы знаем, - ограничено, а что не знаем, - бесконечно».
Лапласа Пьера Симона: «То, что мы знаем, - ограничено, а что не знаем, - бесконечно». Тензор деформаций. Тензор скоростей деформации
Тензор деформаций. Тензор скоростей деформации Спектральный анализ
Спектральный анализ Закон отражения света
Закон отражения света История изобретения паровых машин. Работу выполнила ученица 8б класса МКОУ СОШ пгт Подосиновец Пунченко Анастасия
История изобретения паровых машин. Работу выполнила ученица 8б класса МКОУ СОШ пгт Подосиновец Пунченко Анастасия Магнитное поле
Магнитное поле