Содержание
- 2. План занятия Характеристики электромагнитного излучения; Классификация методов оптического анализа; Основы абсорбционной спектроскопии. Закон Бугера-Ламберта-Бера; Применение спектрофотометрии
- 3. Характеристики электромагнитного излучения Частота, υ, [Гц; 1 Гц = 1с-1] - число колебаний в секунду. Зависит
- 4. Классификация спектроскопических методов Совокупность всех энергий (длин волн, частот) электромагнитного излучения называется электромагнитным спектром. Оптические методы
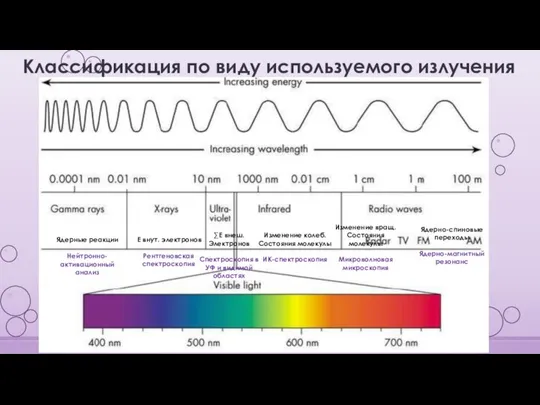
- 5. Классификация по виду используемого излучения Е внут. электронов Рентгеновская спектроскопия Ядерные реакции Нейтронно-активационный анализ ∑Е внеш.
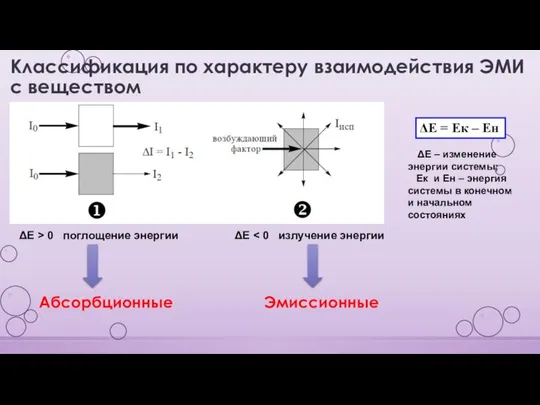
- 6. Классификация по характеру взаимодействия ЭМИ с веществом ΔЕ = Ек – Ен ΔЕ – изменение энергии
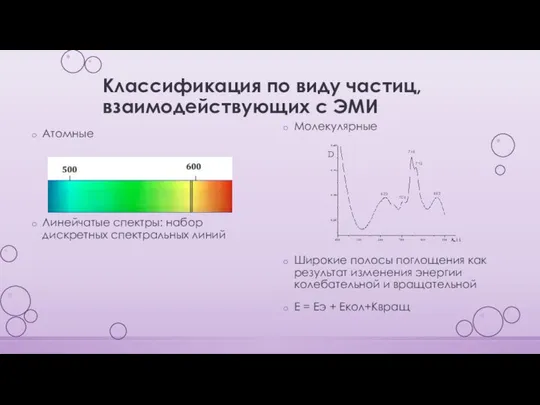
- 7. Классификация по виду частиц, взаимодействующих с ЭМИ Атомные Линейчатые спектры: набор дискретных спектральных линий Молекулярные Широкие
- 8. Основной закон светопоглощения Пропускание (T) I – интенсивность света, прошедшего через раствор I0 – интенсивность падающего
- 9. Основной закон светопоглощения К (коэффициент экстинкции, поглощения) – специфическая физическая константа для каждого вещества, зависит от
- 10. Задача 3. Оптическая плотность стандартного вещества (М.м. = 289 г/моль) с концентрацией 2∙10-4 моль/л в кювете
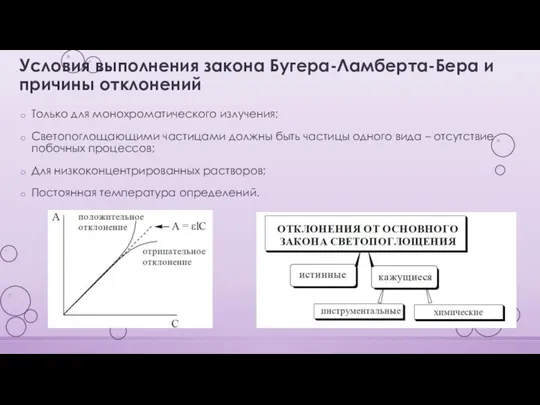
- 11. Условия выполнения закона Бугера-Ламберта-Бера и причины отклонений Только для монохроматического излучения; Светопоглощающими частицами должны быть частицы
- 12. Закон аддитивности оптических плотностей Если в растворе присутствуют несколько соединений, поглощающих излучение одной и той же
- 13. Задача 9. При фотоколориметрическом определении Fe3+ c сульфосалициловой кислотой приготовили ряд стандартных растворов разведением стандартного раствора
- 14. Метод сравнения
- 15. Метод добавок Метод молярного(удельного) коэффициента поглощения (только для спектрофотометрии) По закону Бугера-Ламберта-Бера Задача 12. Определите содержание
- 16. Задачи для решения: 1. Выразите оптическую плотность в процентах пропускания: а)0,054; б)0,801; в)0,521; г)0,205. Ответ: а)88,3%;
- 17. 6. Для построения градуировочного графика в мерные колбы вместимостью 50 мл поместили 2, 3, 4, 5,
- 18. 9. Навеску анилина массой 0.2 г растворяют в 500 мл очищенной воды. К аликвоте 25 мл
- 19. Справочный раздел
- 21. Скачать презентацию

![Характеристики электромагнитного излучения Частота, υ, [Гц; 1 Гц = 1с-1] -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/698830/slide-2.jpg)












 The possibility of modifying the elements of the metal powder assembly with nanoparticles in order to reduce the friction
The possibility of modifying the elements of the metal powder assembly with nanoparticles in order to reduce the friction История изобретения паровых машин. Работу выполнила ученица 8б класса МКОУ СОШ пгт Подосиновец Пунченко Анастасия
История изобретения паровых машин. Работу выполнила ученица 8б класса МКОУ СОШ пгт Подосиновец Пунченко Анастасия Опиливание металла
Опиливание металла Электромагнитные взаимодействия, размеры и форма ядер
Электромагнитные взаимодействия, размеры и форма ядер Явление электромагнитной индукции. Уравнения Максвелла
Явление электромагнитной индукции. Уравнения Максвелла ПОЛНОЕ ВНУТРЕННЕЕ ОТРАЖЕНИЕ СВЕТА
ПОЛНОЕ ВНУТРЕННЕЕ ОТРАЖЕНИЕ СВЕТА Предмет физической химии
Предмет физической химии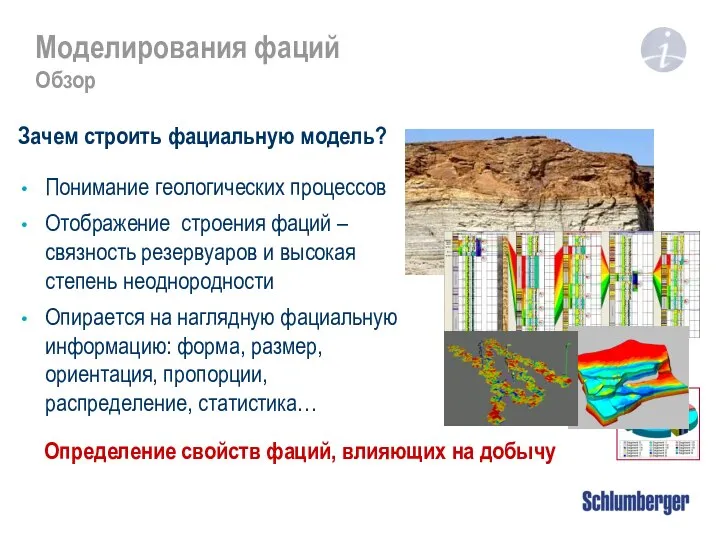 Моделирования фаций. Обзор
Моделирования фаций. Обзор Выполнила учитель физики Омеляшко О.В.
Выполнила учитель физики Омеляшко О.В. Сила трения
Сила трения Соударение твердых тел
Соударение твердых тел Геометрическое движение в физике
Геометрическое движение в физике Механические колебания и их характеристики. Виды колебаний. Механические волны
Механические колебания и их характеристики. Виды колебаний. Механические волны Собственность и доходы
Собственность и доходы Самолеты, используемые в работах по активным воздействиям на атмосферные процессы. Тема 6
Самолеты, используемые в работах по активным воздействиям на атмосферные процессы. Тема 6 Економетричні моделі динаміки
Економетричні моделі динаміки Теория подобия и моделирования
Теория подобия и моделирования Явление электромагнитной индукции
Явление электромагнитной индукции Количественный анализ. Хроматографические методы
Количественный анализ. Хроматографические методы Решение задач: построение изображений в линзах (работа на интерактивной доске)
Решение задач: построение изображений в линзах (работа на интерактивной доске) Давление света
Давление света Статическое электричество, защита от него. Молниеотвод
Статическое электричество, защита от него. Молниеотвод Магнитное поле.Вектор магнитной индукции.
Магнитное поле.Вектор магнитной индукции. Основы электродинамики напрвляющих систем. Уравнения Максвелла
Основы электродинамики напрвляющих систем. Уравнения Максвелла Склокомпозиційні матеріали для спаювання з широким інтервалом ТКЛР
Склокомпозиційні матеріали для спаювання з широким інтервалом ТКЛР Электростатическое поле в диэлектриках
Электростатическое поле в диэлектриках Фотополимерные материалы
Фотополимерные материалы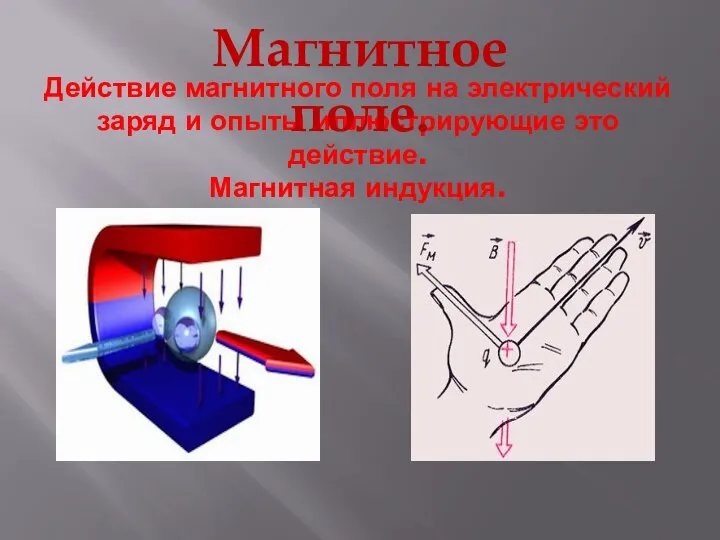 Магнитное поле. Действие магнитного поля на электрический заряд и опыты, иллюстрирующее это действие. Магнитная индукция
Магнитное поле. Действие магнитного поля на электрический заряд и опыты, иллюстрирующее это действие. Магнитная индукция