Содержание
- 2. Распределения молекул. Распределение Максвелла. Средняя, средняя квадратичная и наиболее вероятная скорости молекул. Распределение молекул в поле
- 3. 1. Распределение Максвелла. Средняя, средняя квадратичная и наиболее вероятная скорости молекул. Согласно молекулярно-кинетической теории, как бы
- 4. Исходные положения Максвелла при выводе распределения: - Газ состоит из большого числа N одинаковых молекул. -
- 5. Если разбить диапазон скоростей молекул на малые интервалы dυ, то на каждый интервал скорости будет приходиться
- 6. Функция распределения: особенности зависимости f(υ) от υ: - В показателе экспоненциальной функции имеем взятое с минусом
- 7. Из условия нормировки: находим: Закон Максвелла о распределении молекул по скоростям:
- 8. Наиболее вероятная скорость - скорость, при которой функция распределения молекул идеального газа по скоростям максимальна. Продифференцируем
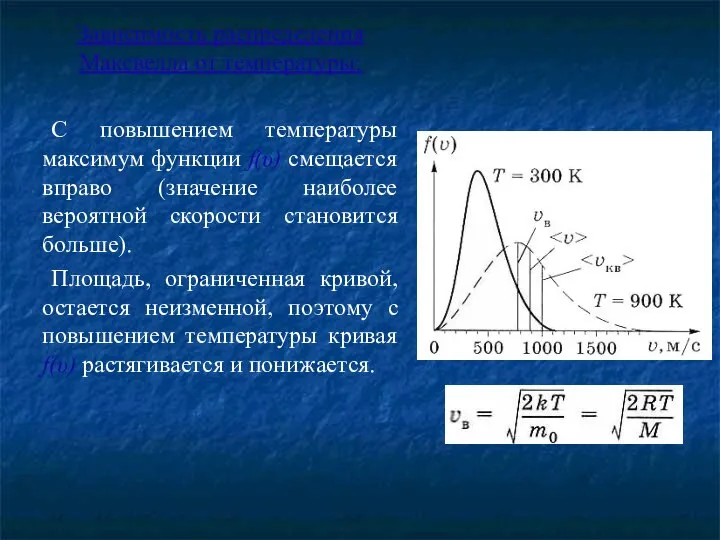
- 9. Зависимость распределения Максвелла от температуры: С повышением температуры максимум функции f(υ) смещается вправо (значение наиболее вероятной
- 10. Средняя скорость:
- 11. Средняя квадратичная скорость молекулы:
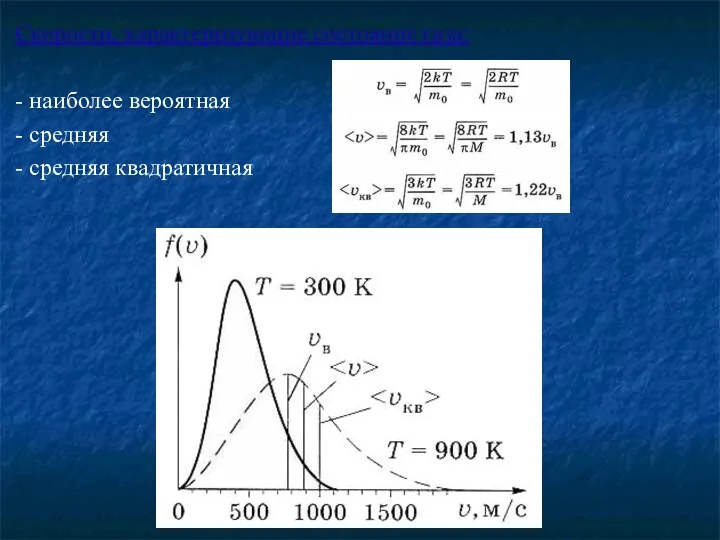
- 12. Скорости, характеризующие состояние газа: - наиболее вероятная - средняя - средняя квадратичная
- 13. Функция распределения молекул по энергиям теплового движения: Вероятность того, что энергии молекул заключены в интервале от
- 14. Число молекул, имеющих кинетическую энергию поступательного движения, заключенную в интервале от ε до dε: Функция распределения
- 15. 2. Распределение молекул в поле внешних сил (распределение Больцмана). Барометрическая формула. Барометрическая формула - зависимость атмосферного
- 16. Если атмосферное давление на высоте h равно р, то на высоте h+dh оно равно p+dp Разность
- 17. Барометрическая формула: Распределение Больцмана: При постоянной температуре плотность газа больше там, где меньше потенциальная энергия его
- 18. 3. Распределение Максвелла-Больцмана.. САМОСТОЯТЕЛЬНО
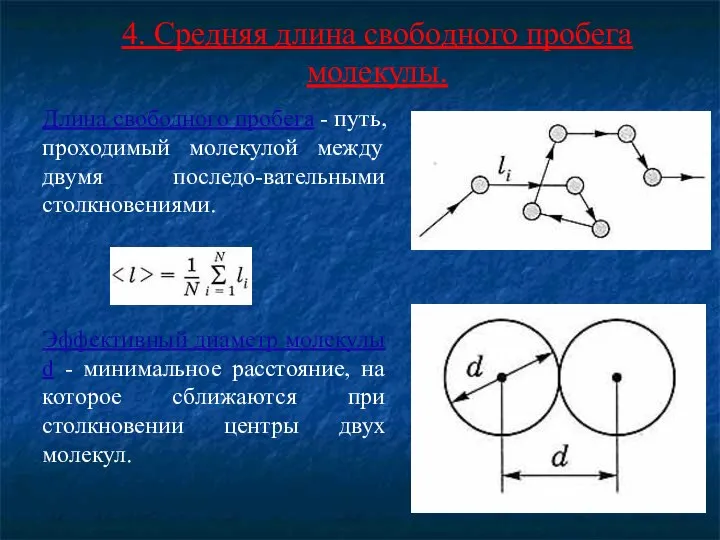
- 19. 4. Средняя длина свободного пробега молекулы. Длина свободного пробега - путь, проходимый молекулой между двумя последо-вательными
- 20. Среднее число столкновений молекулы за 1 с: Модель: молекула в виде шарика диаметром d движется среди
- 22. Скачать презентацию
















 Поляризация света
Поляризация света Строительная акустика. Санитарно-гигиеническая вредность шума
Строительная акустика. Санитарно-гигиеническая вредность шума Региональный чемпионат Молодые профессионалы Москвы по стандартам JuniorSkills
Региональный чемпионат Молодые профессионалы Москвы по стандартам JuniorSkills Урок физики в 8 классе Учитель: Бекетова Т.Г.
Урок физики в 8 классе Учитель: Бекетова Т.Г. Презентация по физике Виды спектров. Спектральный анализ.
Презентация по физике Виды спектров. Спектральный анализ.  Дисперсия света
Дисперсия света  Модель Андерсона для описания магнитных примесей в металле
Модель Андерсона для описания магнитных примесей в металле Изменение фаз газораспределения AB120
Изменение фаз газораспределения AB120 Умник. Моделирование инновационных конструкций радиоприемных антенных излучателей для обнаружения и идентификации объектов
Умник. Моделирование инновационных конструкций радиоприемных антенных излучателей для обнаружения и идентификации объектов Презентация по физике "Солнце" - скачать
Презентация по физике "Солнце" - скачать  Биофизика мембран Транспорт веществ. (Лекция 6)
Биофизика мембран Транспорт веществ. (Лекция 6) Қатты денелерден зарядталған бөлшектерді шығару əдістері (эмиссия)
Қатты денелерден зарядталған бөлшектерді шығару əдістері (эмиссия) Единицы измерения
Единицы измерения Применение технологии перевернутый класс в обучении физике учащихся основной школы
Применение технологии перевернутый класс в обучении физике учащихся основной школы Современные источники энергии
Современные источники энергии Реконструкция электроснабжения потребителей от ПС "Астапковичи" 35/10 кВ Рославльского района Смоленской области
Реконструкция электроснабжения потребителей от ПС "Астапковичи" 35/10 кВ Рославльского района Смоленской области Жарық дифракциясы. Френельдің аумақ әдісі. Жарықтың түзу сызықпен таралуы. Аумақ пластинасы
Жарық дифракциясы. Френельдің аумақ әдісі. Жарықтың түзу сызықпен таралуы. Аумақ пластинасы Фазированные антенные решетки и их назначение. Надежность ФАР
Фазированные антенные решетки и их назначение. Надежность ФАР Моделирование взаимодействия деформируемого ударника с металлической преградой в пакете LS-DYNA
Моделирование взаимодействия деформируемого ударника с металлической преградой в пакете LS-DYNA Основные понятия и определения теоретической механики
Основные понятия и определения теоретической механики Датчики термоанемометров
Датчики термоанемометров Сварочная дуга как источник тепла
Сварочная дуга как источник тепла Первый закон Ньютона
Первый закон Ньютона Презентация по физике Люксметр
Презентация по физике Люксметр  Динамика вращательного движения твердого тела. Лекция 5
Динамика вращательного движения твердого тела. Лекция 5 Реализация проекта строительства атомной электростанции в Республике Беларусь
Реализация проекта строительства атомной электростанции в Республике Беларусь Квантовая статистика Ферми - Дирака. Квантовая статистика Бозе - Эйнштейна. (Лекция 8б)
Квантовая статистика Ферми - Дирака. Квантовая статистика Бозе - Эйнштейна. (Лекция 8б) Набор высоты
Набор высоты