Слайд 2

I. Введение
I. Электрический ток в растворах электролитов
Вещества, растворы которых проводят электрический
ток, называются электролитами. Электрический ток в жидких проводниках—в растворах электролитов (растворах солей, кислот, щелочей и др.) представляет собой поток заряженных частиц вещества — ионов. Ионы возникают в растворе вследствие взаимодействия молекул растворяемого вещества с молекулами растворителя (воды).
Ионы в растворах электролитов, как и свободные электроны в металлах, движутся беспорядочно. Но когда электроды присоединяют к полюсам источника тока, в растворе возникает электрическое поле. Под воздействием поля ионы, сохраняя хаотическое движение, одновременно начинают двигаться в определенном направлении. Положительные ионы направляются к электроду, соединенному с отрицательным полюсом источника (катоду), а отрицательные ионы — к электроду, соединенному с положительным полюсом (аноду). Дойдя до соответствующих электродов, ионы отдают им свои заряды и, став атомами или молекулами, выделяются на электродах или вступают в химические реакции.
При растворении электролита в жидкости, например хлорида натрия в воде, взаимодействие молекул жидкости с молекулами электролита ослабляет связь между частями молекул электролита, и некоторые из них разделяются на положительные и отрицательные ионы. Разделение молекул электролита на ионы происходит за счет энергии теплового движения молекул. В электрическом поле ионы электролита приходят в движение: положительные ионы движутся к катоду, отрицательные — к аноду. Так возникает электрический ток в электролите.
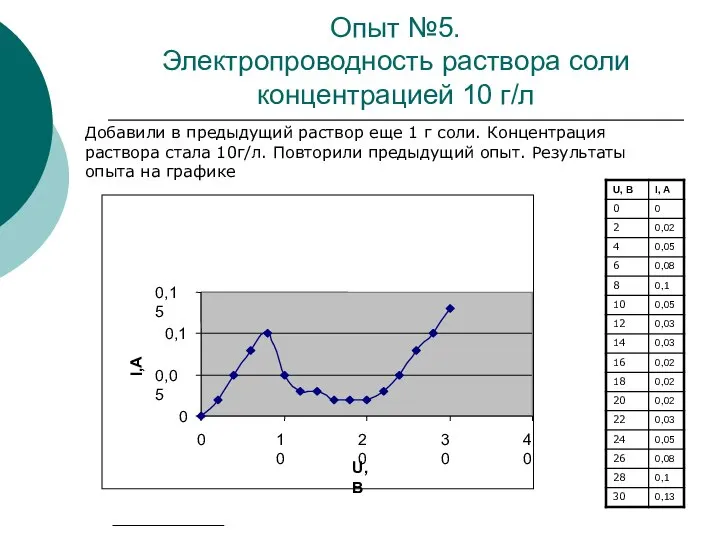
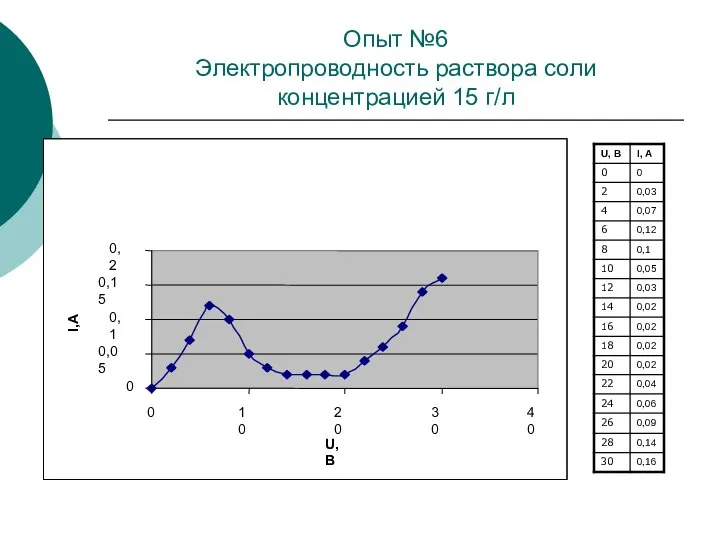
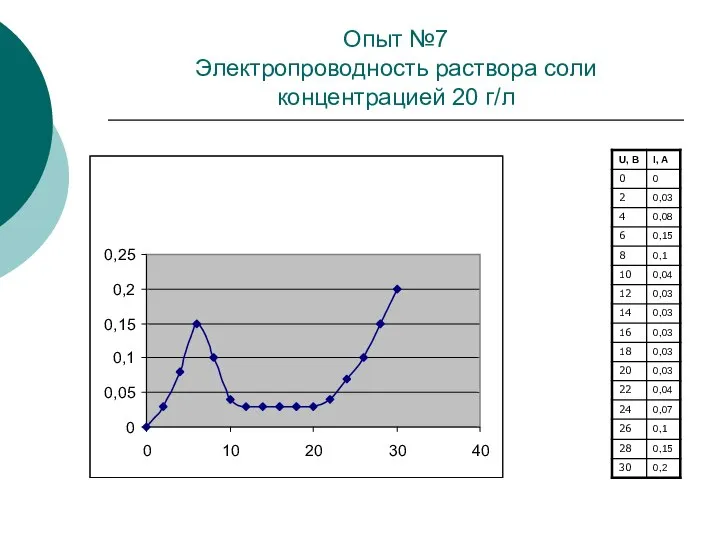
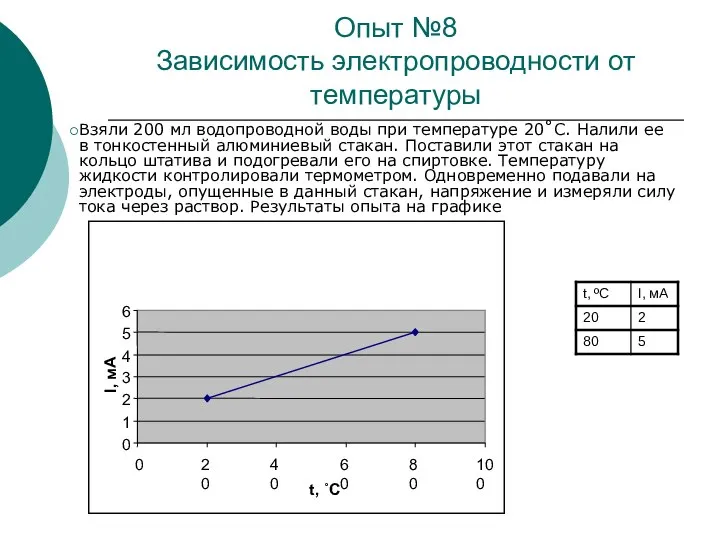
При повышении температуры кинетическая энергия движения молекул возрастает, что приводит к увеличению числа пар образующихся ионов, то есть к увеличению концентрации электролита. Из-за увеличения концентрации ионов значение электрического сопротивления электролита с повышением температуры уменьшается.
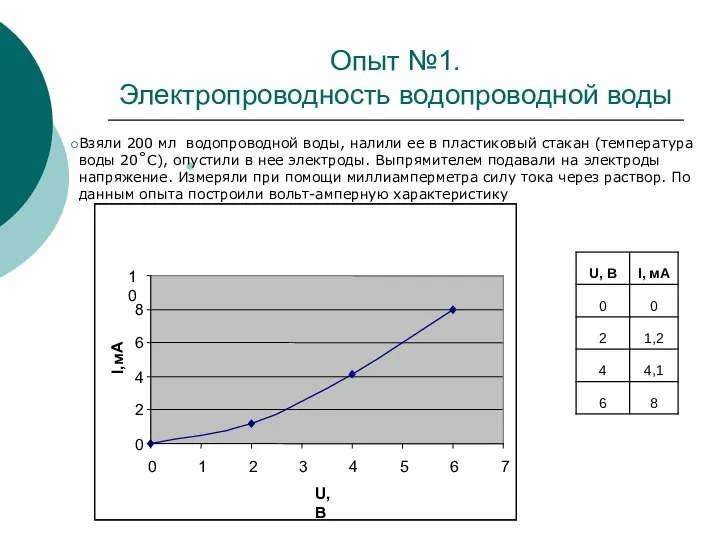
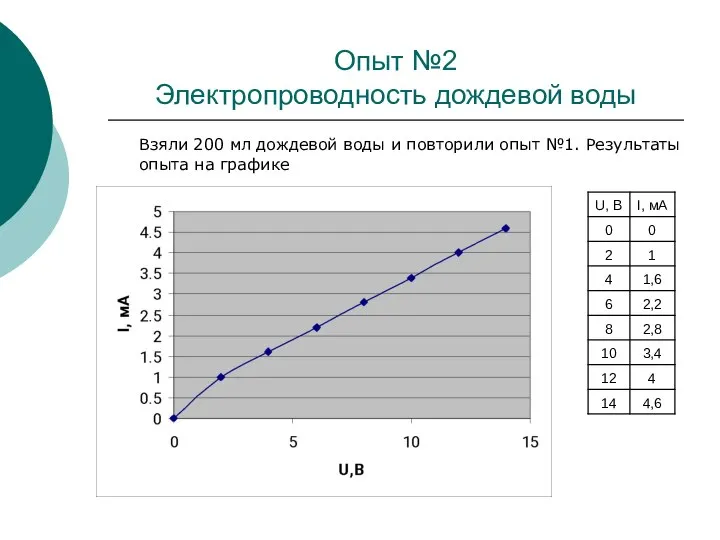
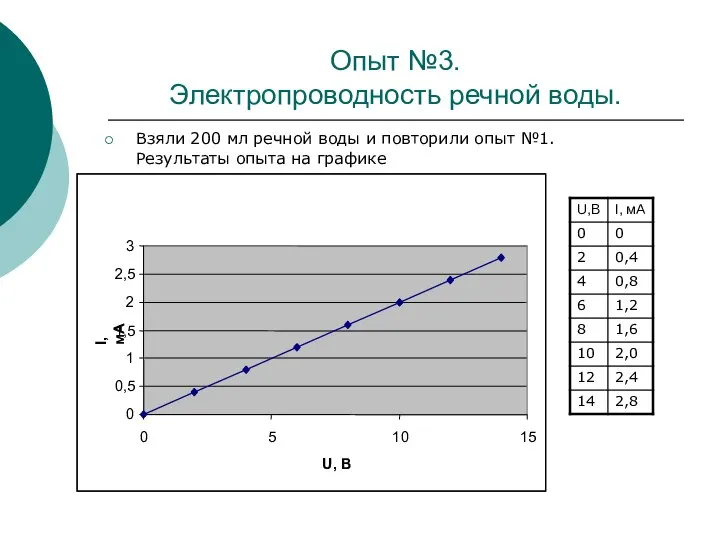
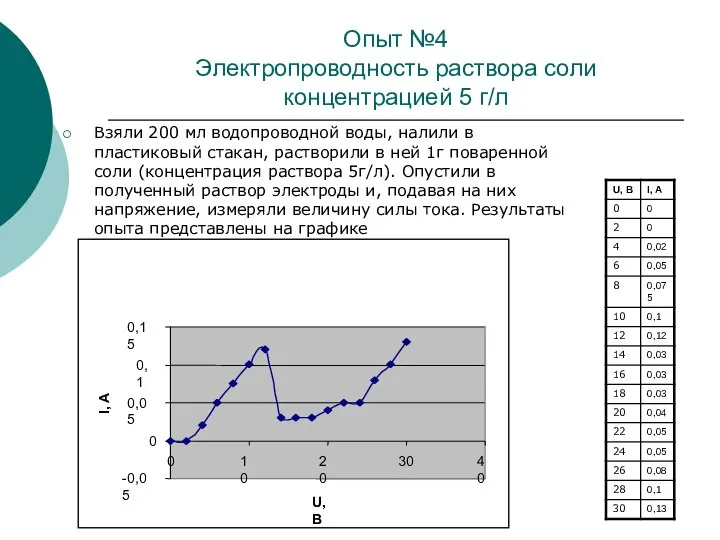
В данной исследовательской работе проводились опыты по определению зависимости силы тока от напряжения в водных растворах в зависимости от температуры, концентрации электролита и рода вещества раствора.
Цель данной работы – выяснить, насколько используемая человеком вода является чистой, и сделать сравнительный анализ используемой воды.










 Денелердің жүзу шарттары
Денелердің жүзу шарттары Мерседес 230е м102. Переход на инжектор
Мерседес 230е м102. Переход на инжектор Законы сохранения энергии и импульса
Законы сохранения энергии и импульса Электрический ток в различных средах
Электрический ток в различных средах Энергетические ресурсы Мирового океана
Энергетические ресурсы Мирового океана Уравнения и электромагнитная теория Максвелла
Уравнения и электромагнитная теория Максвелла Презентацию к уроку выполнила учитель физики первой квалификационной категории МОУ «Горютинская СОШ» Баранцева Светлана Никола
Презентацию к уроку выполнила учитель физики первой квалификационной категории МОУ «Горютинская СОШ» Баранцева Светлана Никола Молекулярно-кинетическая теория
Молекулярно-кинетическая теория Электростатические спектрометры заряженных частиц
Электростатические спектрометры заряженных частиц Поляризация диэлектриков
Поляризация диэлектриков Моя любимая профессия техника-механика
Моя любимая профессия техника-механика Графическое представление тепловых процессов Т.И. Звягина, 2012 г. ГБОУ СОШ № 644 г. Санкт-Петербург
Графическое представление тепловых процессов Т.И. Звягина, 2012 г. ГБОУ СОШ № 644 г. Санкт-Петербург Рентгеновское излучение, радиоактивность. Взаимодействие ионизирующего излучения с веществом. Дозиметрия ионизирующего излучен
Рентгеновское излучение, радиоактивность. Взаимодействие ионизирующего излучения с веществом. Дозиметрия ионизирующего излучен Қыздыру үдерістері
Қыздыру үдерістері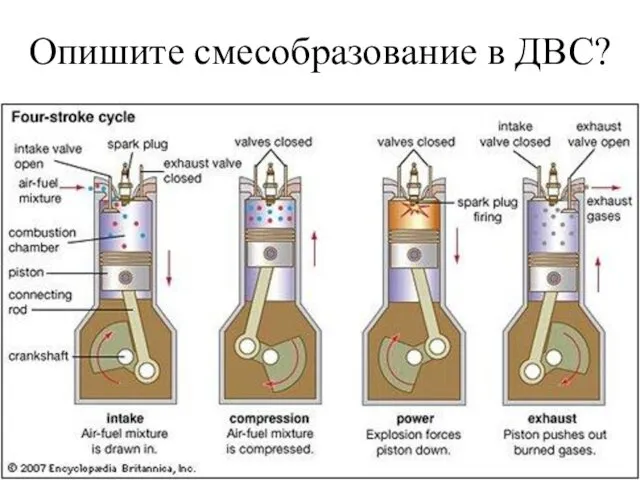 Смесеобразование в ДВС
Смесеобразование в ДВС Задача № 2 на расчет плотности тела
Задача № 2 на расчет плотности тела Величины, характеризующие колебательное движение
Величины, характеризующие колебательное движение Строение атома. Планетарная модель атома
Строение атома. Планетарная модель атома Пространственная структура рассеяния (лекция 6)
Пространственная структура рассеяния (лекция 6) Организация ремонта электрических машин пассажирских вагонов
Организация ремонта электрических машин пассажирских вагонов Кертис Гебер аргументтері
Кертис Гебер аргументтері Графическое представление газовых процессов Базовый уровень 10 класс
Графическое представление газовых процессов Базовый уровень 10 класс Кинематика материальной точки и поступательного движения твердого тела
Кинематика материальной точки и поступательного движения твердого тела Конденсаторы. Задачи на соответствия из 1 и 2 части ЕГЭ
Конденсаторы. Задачи на соответствия из 1 и 2 части ЕГЭ Презентация по физике "Люмінесценція" - скачать бесплатно
Презентация по физике "Люмінесценція" - скачать бесплатно Проводники в электрическом поле
Проводники в электрическом поле Механические колебания и волны
Механические колебания и волны Экспериментальные исследования нагрева и зажигания растительных горючих материалов
Экспериментальные исследования нагрева и зажигания растительных горючих материалов