Содержание
- 2. Теплоемкости газов Теплоемкость – это теплота, которую надо подвести к единичному количеству вещества, чтобы увеличить его
- 3. Соотношения между теплоемкостями где Q – теплота, Дж; m – масса газа, кг; V0 – объем
- 4. Теплоемкости смесей газов Чтобы повысить температуру смеси газов на ΔT К, надо на столько же нагреть
- 5. Массовая, объемная и мольная теплоемкости Учтем, что: mi /m=gi – массовая доля компонента; V0i /V0=ri –
- 6. I закон термодинамики для изохорного и изобарного процессов Запишем выражение I закона термодинамики для этих случаев:
- 7. Теплоемкости cp и cv В изобарном процессе подведенная теплота расходуется на изменение внутренней энергии газа и
- 8. Показатель адиабаты А отношение теплоемкостей cp и cv– показатель адиабаты: k=cp /cv. Одноатомные газы: k=1,67; двухатомные
- 9. Истинная теплоемкость На графике представлены зависимости теплоемкостей от температуры: 1 – одноатомных газов: c=a=Const; 2 –
- 10. Средняя теплоемкость двухатомных газов Теплота, подведенная к двухатомному газу, запишется как dq=cdt, или в интегральном виде:
- 11. Определение теплоемкостей по формулам и таблицам На предыдущих слайдах были приведены формулы истинных и средних теплоемкостей
- 12. Табличные теплоемкости Теплоту, подведенную к газу в процессе 1-2 можно выразить как: q1-2=q5-2–q5-1= =пл.52305–пл.51405 = =cm0t2t2–cm0t1t1=cm
- 13. Средние мольные теплоемкости (μс)р, кДж/(кмоль·К) Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2014
- 14. Термодинамическая поверхность идеального газа T1>T2>T3 T1=const T2=const T3=const p v T p=const v=const p v v
- 15. Термодинамическая поверхность воды Область сублимации v Влажный пар Т р Перегретый пар Лед Область плавления Вода
- 16. Термодинамические процессы Изохорный – процесс при неизменном объеме газа: v=сonst. Изобарный – при постоянном давлении газа:
- 17. Исследование термодинамических процессов Чтобы выявить основные закономерности изменения состояния газа и особенностей превращения энергии, выполняется исследование
- 18. Методика исследования термодинамических процессов 5. Находится работа газа против внешних сил . 6. Определяется теплота, подведенная
- 19. Исследование изохорного процесса 1. Уравнение v=сonst. 2. pv-диаграмма. 3. Соотношения между p,v,T – из уравнения Клапейрона:
- 20. Изохорный процесс 4. Изменение внутренней энергии: Δu=cvΔT. 5. Работа , так как v=сonst. 6. Теплота: из
- 21. Исследование изобарного процесса 1. Уравнение p=сonst. 2. pv-диаграмма. 3. Соотношения между p,v,T – из уравнения Клапейрона
- 22. Изобарный процесс 4. Изменение внутренней энергии: Δu=cvΔT. 5. Работа: =p(v2-v1)=R(T2-T1). 6. Теплота: из I закона термодинамики
- 23. Преобразование выражения I закона термодинамики Запишем выражение I закона термодинамики и преобразуем его следующим образом: dq=du+pdv+vdp-vdp=
- 24. Параметр состояния энтальпия Тогда можно записать аналитическое выражение I закона термодинамики через энтальпию: dq=dh-vdp. Здесь h=u+pv=cvT+RT=(cv+R)T=cpT,
- 25. Исследование изотермического процесса 1. Уравнение T=сonst. 2. pv-диаграмма. 3. Соотношения между p,v,T – из уравнения Клапейрона
- 26. Исследование изотермического процесса 4. Изменение внутренней энергии: Δu=cvΔT=0. Подстановка для работы pv=p1v1; p=p1v1/v. 5. Работа: .
- 27. Исследование адиабатного процесса Уравнение адиабаты выводится из I закона термодинамики: dq=0=du+pdv или cvdT+pdv=0. Сделаем подстановку из
- 28. Преобразования выражения I закона термодинамики С учетом уравнения Майера R=cp-cv: pdv+vdp+(cp-cv)pdv/cv=0. Или с учетом показателя адиабаты
- 29. Уравнение адиабатного процесса После приведения подобных членов и сокращения имеем: vdp+kpdv=0. Разделим переменные, поделив уравнение на
- 30. pv-диаграмма адиабатного процесса 2. pv-диаграмма. Легко доказать, что адиабата идет круче изотермы. При p1=idem, p2=idem: v2T/v1=p1/p2;
- 31. Соотношения между параметрами 3. Соотношения между p и v из уравнения процесса: p1v1k=p2v2k: p2/p1=(v1/v2)k; (1) (p2/p1)1/k=v1/v2
- 32. Внутренняя энергия и работа газа Подставляем (2) в (3): (p2/p1)(p2/p1)-1/k=T2/T1, получаем соотношение между p и T:
- 34. Скачать презентацию































 Закон Паскаля
Закон Паскаля  Ионизация воздуха
Ионизация воздуха Дисколёты - часть 2
Дисколёты - часть 2 Типы ракетных двигателей
Типы ракетных двигателей Двигатели внутреннего сгорания. Эксплуатация и ремонт базовых машин бронетанковой техники
Двигатели внутреннего сгорания. Эксплуатация и ремонт базовых машин бронетанковой техники Науковий образ світу
Науковий образ світу Реактивний двигун, прямоточний повітряно-реактивний двигун, галузь застосування Підготувала учениця 10-Ф класу Семененкр Анна
Реактивний двигун, прямоточний повітряно-реактивний двигун, галузь застосування Підготувала учениця 10-Ф класу Семененкр Анна  1. Законы соединений. 2. Задачи.
1. Законы соединений. 2. Задачи. Образование линий. Квантовая теория излучения. (Тема 11)
Образование линий. Квантовая теория излучения. (Тема 11) Деление ядер урана. Цепная реакция
Деление ядер урана. Цепная реакция Аттестационная работа. Определение средней скорости черепахи. физика. 7 класс
Аттестационная работа. Определение средней скорости черепахи. физика. 7 класс Технология формирования тестовых заданий по дисциплине «Механика сплошной среды»
Технология формирования тестовых заданий по дисциплине «Механика сплошной среды» Циклотрон
Циклотрон Статика. «Дайте мне точку опоры, и я подниму Землю!»
Статика. «Дайте мне точку опоры, и я подниму Землю!» Явление электромагнитной индукции. Магнитный поток
Явление электромагнитной индукции. Магнитный поток Расчет теплообменных аппаратов
Расчет теплообменных аппаратов Обработка экспериментальных данных. Часть 1
Обработка экспериментальных данных. Часть 1 Сложное движение точки
Сложное движение точки Источники света. Распространение света
Источники света. Распространение света Механические колебания. (9 класс)
Механические колебания. (9 класс)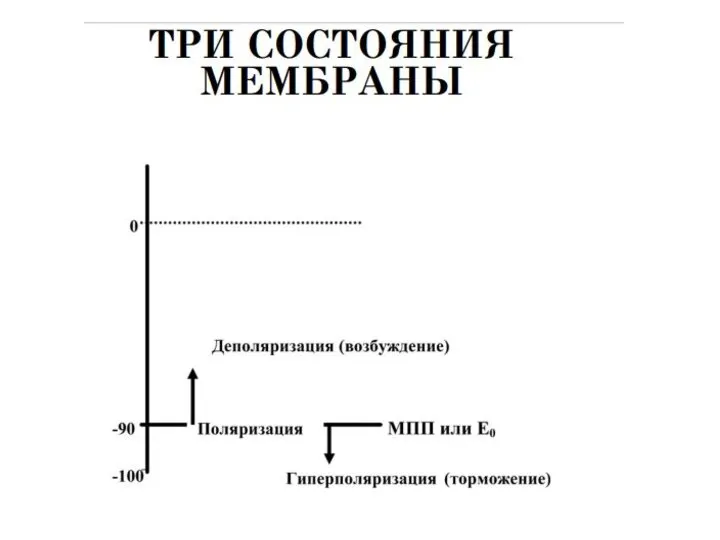 Три состояния мембраны
Три состояния мембраны Сила Лоренца
Сила Лоренца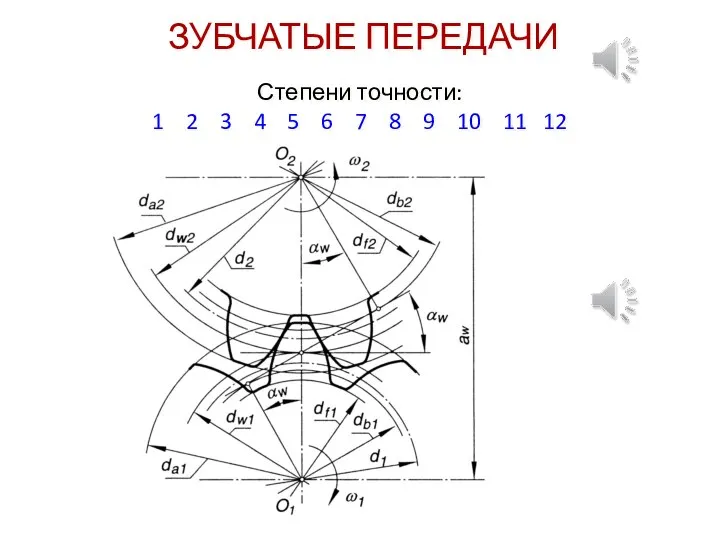 Зубчатые передачи
Зубчатые передачи Отражение и преломление электромагнитных волн на границе раздела сред
Отражение и преломление электромагнитных волн на границе раздела сред Урок физики 7 класс Учитель физики МОУ СОШ №4 г.Миньяра УСКОВА СВЕТЛАНА
Урок физики 7 класс Учитель физики МОУ СОШ №4 г.Миньяра УСКОВА СВЕТЛАНА Определение давления тела на опору
Определение давления тела на опору Излучение Хокинга
Излучение Хокинга Курс лекций. Электрический привод
Курс лекций. Электрический привод