Приращение внутренней энергии
Внутреннюю энергию тела можно изменить двумя способами ‒ путем
совершения работы и путем теплообмена. При осуществлении первого из этих способов внутренняя энергия тела изменяется на величину совершенной работы А, а при осуществлении второго из них ‒ на величину, равную количеству переданной теплоты Q.
Энергия U, работа А и переданная теплота Q выражается в Джоулях (Дж)
Лирическое отступление: Обозначим начальное значение некоторой физической величины как В1, а конечное значение (после того, как она изменилась) ‒ как В2. Тогда изменение физической величины, равное разности В2 ‒ В1 будем называть приращением этой физической величины и обозначать его как ΔВ = В2 ‒ В1
Поэтому мы можем записать, что приращение внутренней энергии
Δ U = U2 ‒ U1
Если внутренняя энергия тела увеличивается, то U2 > U1, следовательно, ΔU > 0;
Если внутренняя энергия тела уменьшается, то U2 < U1, следовательно, ΔU < 0.
В зависимости от того, каким способом (путем совершения над телом работы или путем теплообмена или обоими способами одновременно) изменялась внутренняя энергия, ее приращение:
Приращение внутренней энергии системы равно, сумме работы внешних сил и количества теплоты, полученного системой.
ΔU = U2 – U1 = A + Q













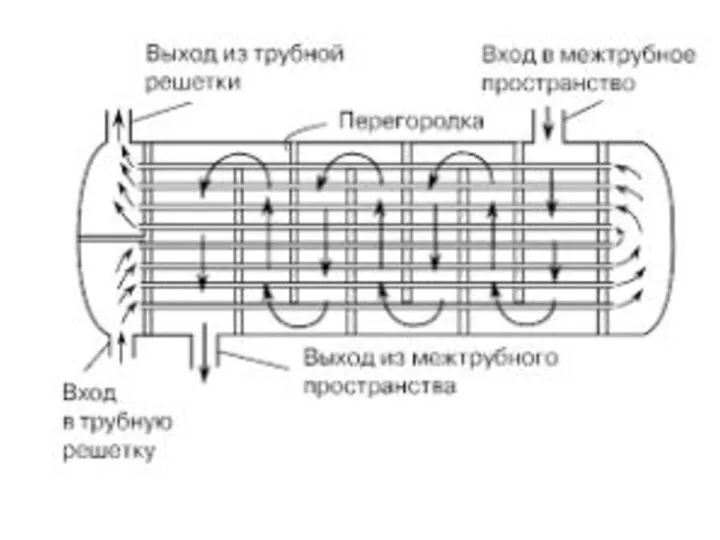 Теплообменные аппараты
Теплообменные аппараты Механические колебания. Свойства ультразвука
Механические колебания. Свойства ультразвука Плотность вещества
Плотность вещества Муфта сцепления
Муфта сцепления Сверхпроводимость и теория Гинсбурга-Ландау
Сверхпроводимость и теория Гинсбурга-Ландау Поверхностный эффект в проводниках. (VI)
Поверхностный эффект в проводниках. (VI) Максимальная токовая защита
Максимальная токовая защита Инструмент, применяемый в слесарном деле
Инструмент, применяемый в слесарном деле Неньютоновские жидкости и их свойства
Неньютоновские жидкости и их свойства Дифракция электронов
Дифракция электронов Напівпровідникові прилади та їх застосування Проектна робота Учениці 11 класу Дурман Анни
Напівпровідникові прилади та їх застосування Проектна робота Учениці 11 класу Дурман Анни 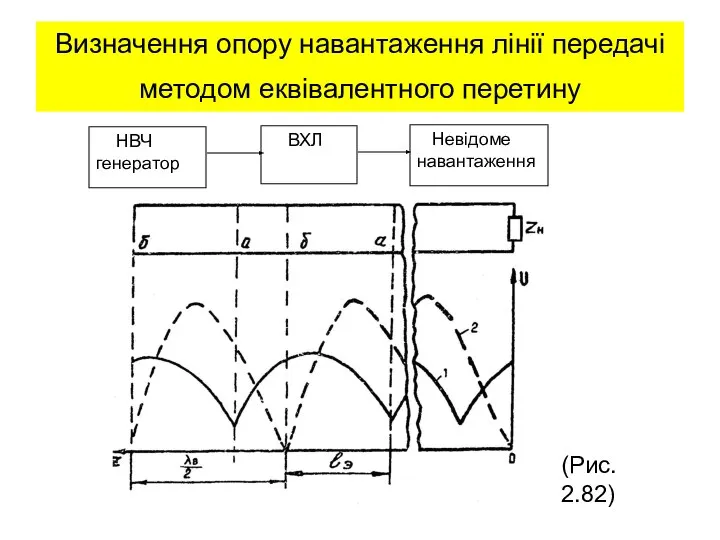 Визначення опору навантаження лінії передачі методом еквівалентного перетину. (Лекция 15)
Визначення опору навантаження лінії передачі методом еквівалентного перетину. (Лекция 15) Механические колебания и волны
Механические колебания и волны Презентация Самоиндукция
Презентация Самоиндукция  Электричество в живых организмах
Электричество в живых организмах Мультиплексная (MPX) система передачи данных: электронные блоки управления
Мультиплексная (MPX) система передачи данных: электронные блоки управления Проекционный аппарат
Проекционный аппарат Объединенный газовый закон
Объединенный газовый закон Автор: Карпова Елена Валерьевна МОУ Гимназия №1 10 «Т» класс
Автор: Карпова Елена Валерьевна МОУ Гимназия №1 10 «Т» класс  B13. Задачи на движение по прямой
B13. Задачи на движение по прямой Экспертные советы по теоретической физике
Экспертные советы по теоретической физике Траектория – линия движения тела
Траектория – линия движения тела Релейная защита и автоматика
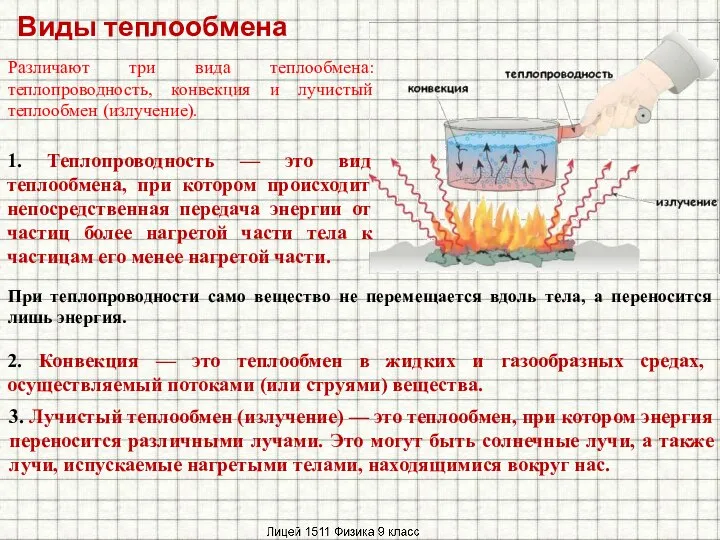
Релейная защита и автоматика Конвективный теплообмен
Конвективный теплообмен Радиотехнические системы. Вводная лекция
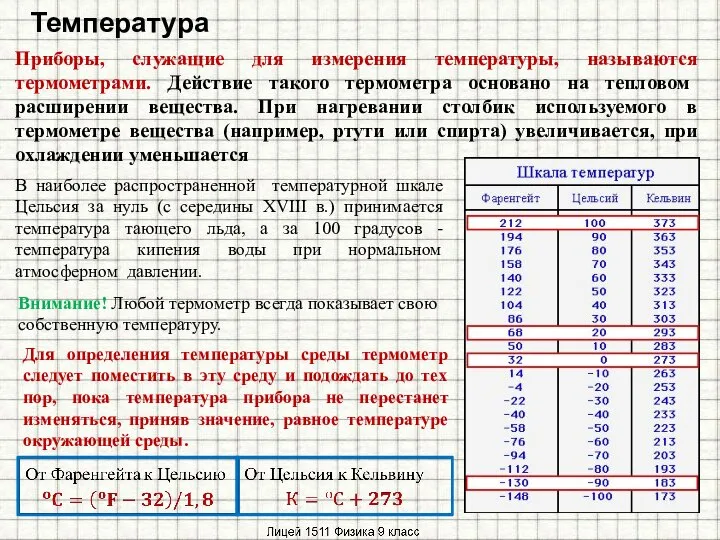
Радиотехнические системы. Вводная лекция ТЕРМОМЕТР
ТЕРМОМЕТР 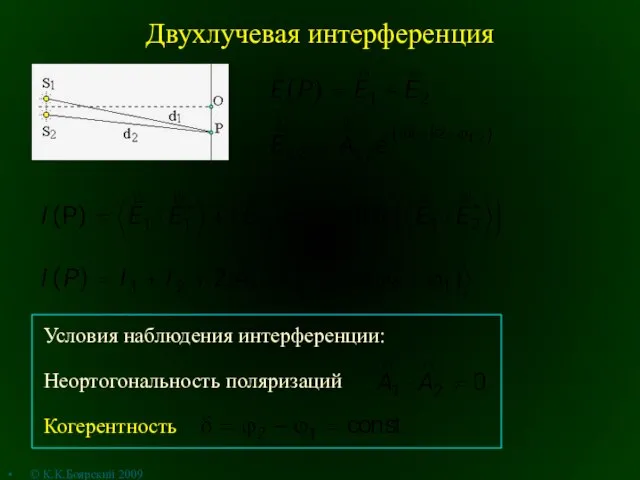 Двухлучевая интерференция
Двухлучевая интерференция Лазеры. Спонтанное и вынужденное излучение
Лазеры. Спонтанное и вынужденное излучение