Содержание
- 2. Законы поглощения света Интенсивность поглощения монохроматического излучения, проходящего через вещество, определяется законом Бугера–Ламберта (1729 г., 1760
- 3. Законы поглощения света Отношение – оптическая плотность, обозначаемая D: D = k·l (7) Второй закон, сформулированный
- 4. Молярный коэффициент Если с выражается в моль/л, а l − в см, то коэффициент поглощения k
- 5. Изображение спектров поглощения Спектральные данные записываются в виде кривой, где на оси абсцисс (х) откладывается фактор
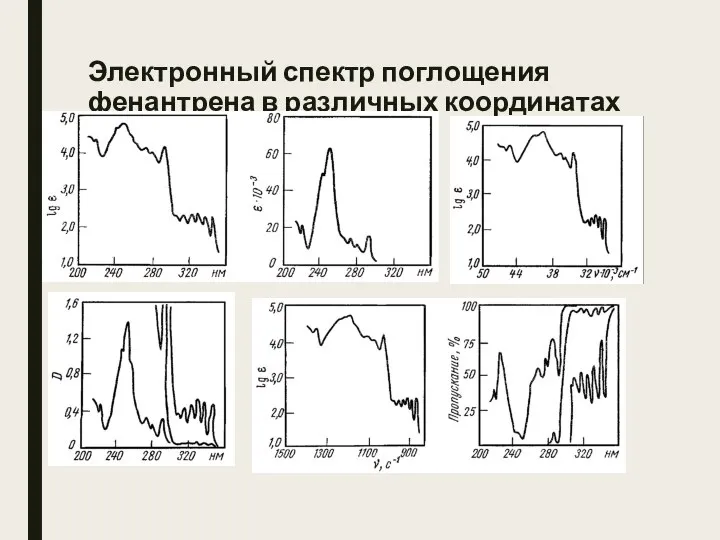
- 6. Электронный спектр поглощения фенантрена в различных координатах
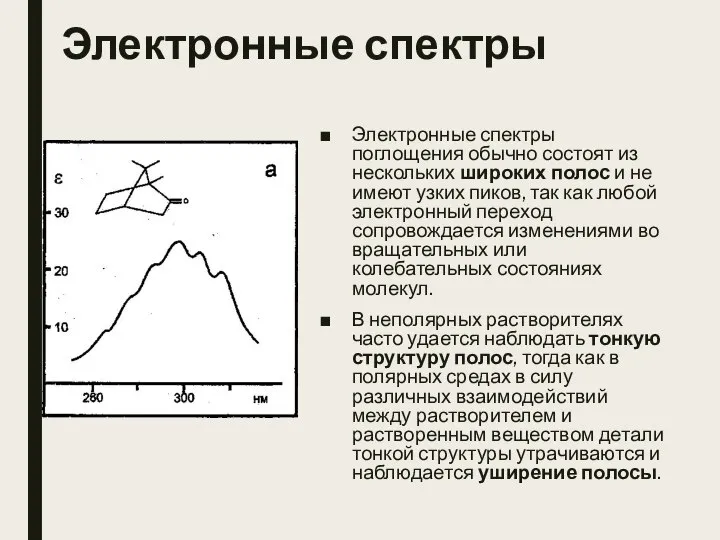
- 7. Электронные спектры Электронные спектры поглощения обычно состоят из нескольких широких полос и не имеют узких пиков,
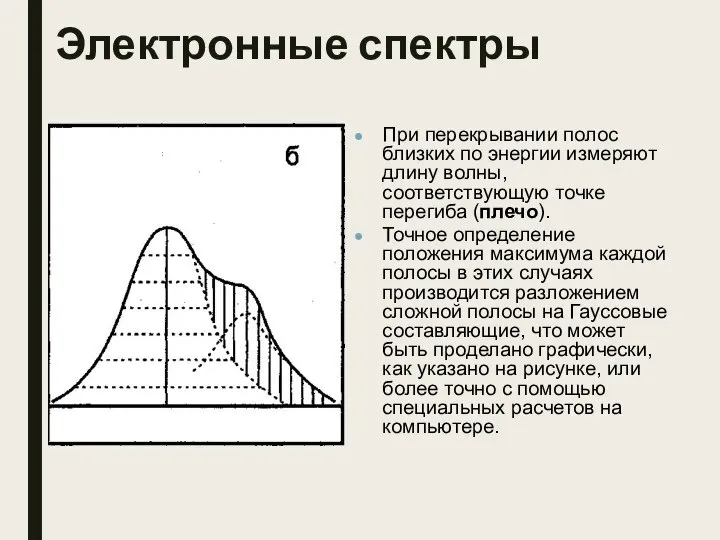
- 8. Электронные спектры При перекрывании полос близких по энергии измеряют длину волны, соответствующую точке перегиба (плечо). Точное
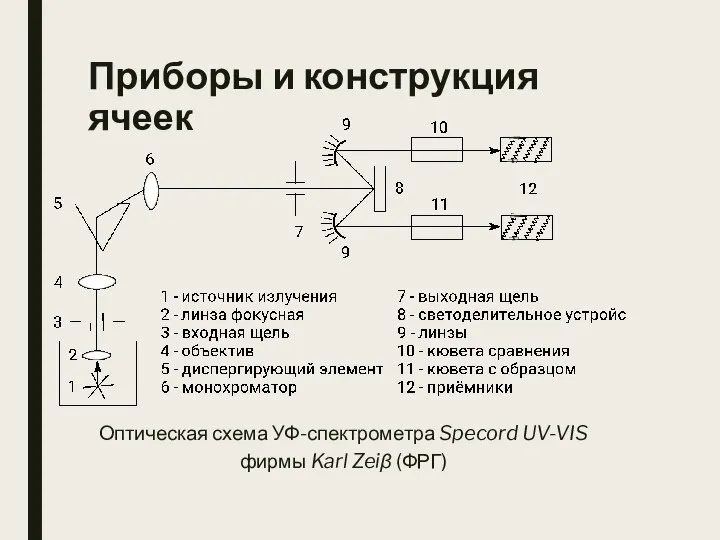
- 9. Приборы и конструкция ячеек Оптическая схема УФ-спектрометра Specord UV-VIS фирмы Karl Zeiβ (ФРГ)
- 10. Приготовление образцов Обычно УФ-спектры поглощения исследуется в растворе, реже в газовой фазе. Главный источник погрешности при
- 11. Приготовление образцов Главное требование к растворителям – прозрачность в области исследуемого поглощения и инертность по отношению
- 12. Пределы пропускания растворителей в УФ-области
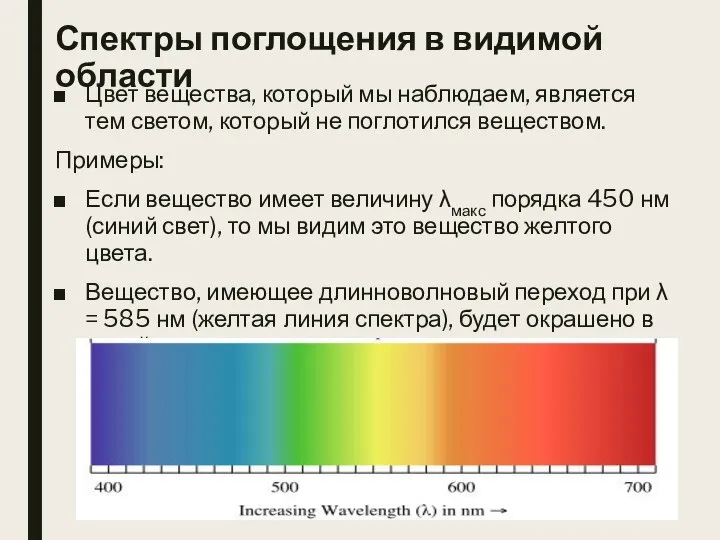
- 13. Спектры поглощения в видимой области Цвет вещества, который мы наблюдаем, является тем светом, который не поглотился
- 14. Окраска вещества и цвета излучения, поглощенного веществом
- 15. Теория цветности Витта В 1876 г. Витт О. предложил хромофорную теорию органических красителей, согласно которой окраска
- 16. Сдвиги в УФ-спектре Сдвиг по максимуму поглощения в сторону более длинных волн вследствие замещения или влияния
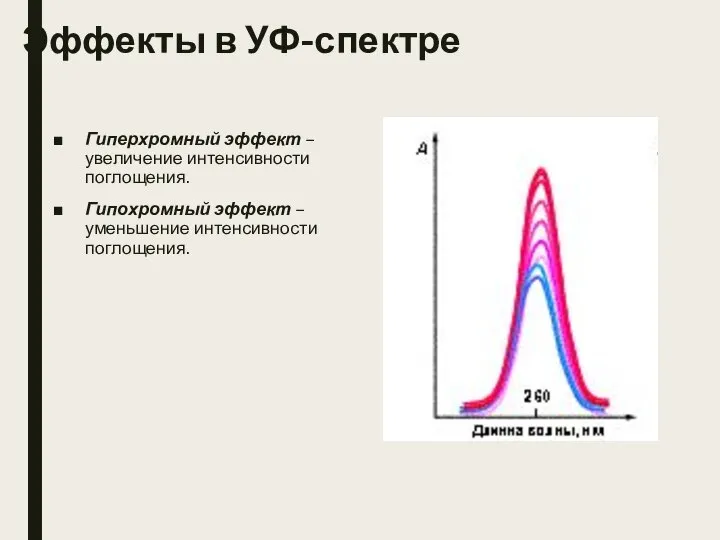
- 17. Эффекты в УФ-спектре Гиперхромный эффект – увеличение интенсивности поглощения. Гипохромный эффект – уменьшение интенсивности поглощения.
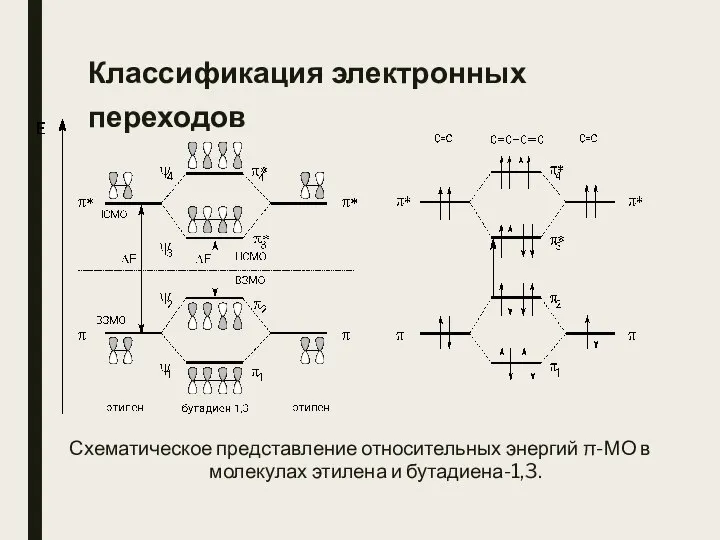
- 18. Классификация электронных переходов Схематическое представление относительных энергий π-МО в молекулах этилена и бутадиена-1,3.
- 19. Классификация Каша М. (1968 г.) Соответственно переходы подразделяются на: σ→σ*, π→π*, n→σ*, n→π* Для многоатомных молекул
- 20. СПЕКТРЫ ПОГЛОЩЕНИЯ ОСНОВНЫХ КЛАССОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 21. Алканы и циклоалканы В насыщенных углеводородах возможны только σ→σ*-переходы. Это дальняя область УФ. λмакс Из-за экспериментальных
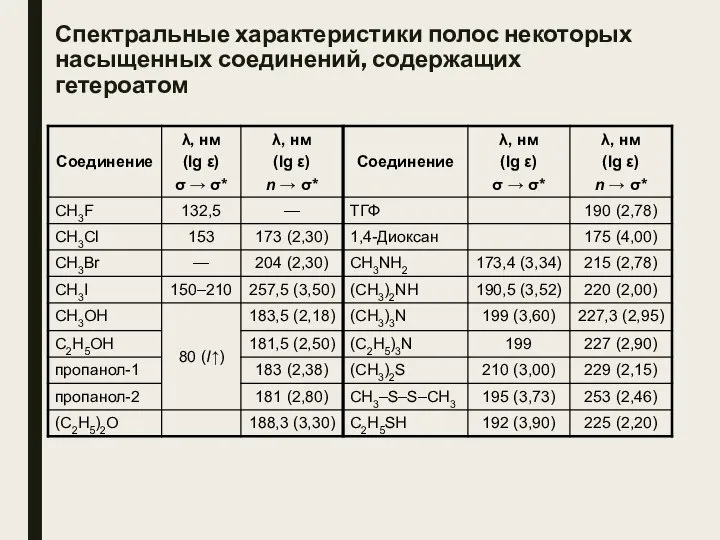
- 22. Спектральные характеристики полос некоторых насыщенных соединений, содержащих гетероатом
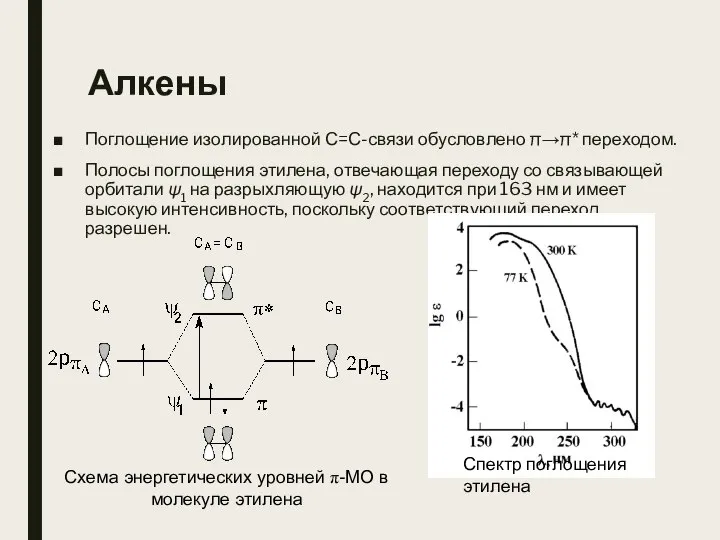
- 23. Алкены Поглощение изолированной С=С-связи обусловлено π→π* переходом. Полосы поглощения этилена, отвечающая переходу со связывающей орбитали ψ1
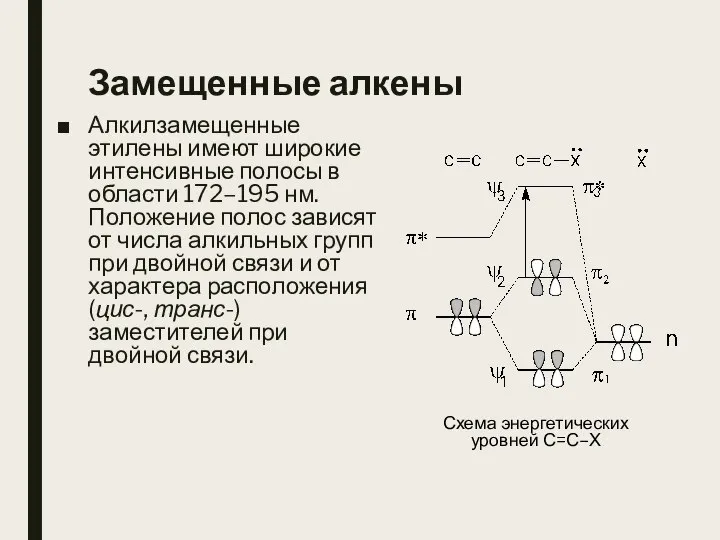
- 24. Замещенные алкены Алкилзамещенные этилены имеют широкие интенсивные полосы в области 172–195 нм. Положение полос зависят от
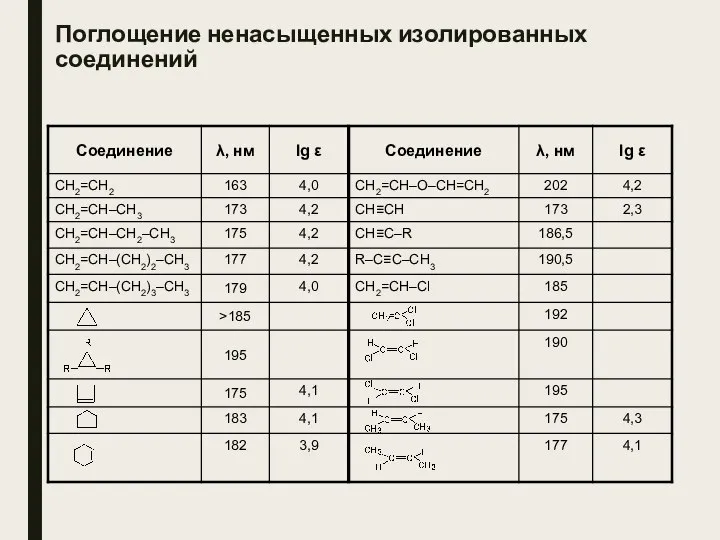
- 25. Поглощение ненасыщенных изолированных соединений
- 26. Алкины Для ацетиленовых углеводородов с изолированной С≡С связью наблюдается полоса π→π* перехода. Алкилзамещенные ацетилены имеют ту
- 27. Диены, полиены и полиины Несопряженные диолефины имеют такие же полосы поглощения, как и моноолефины. При сопряжении
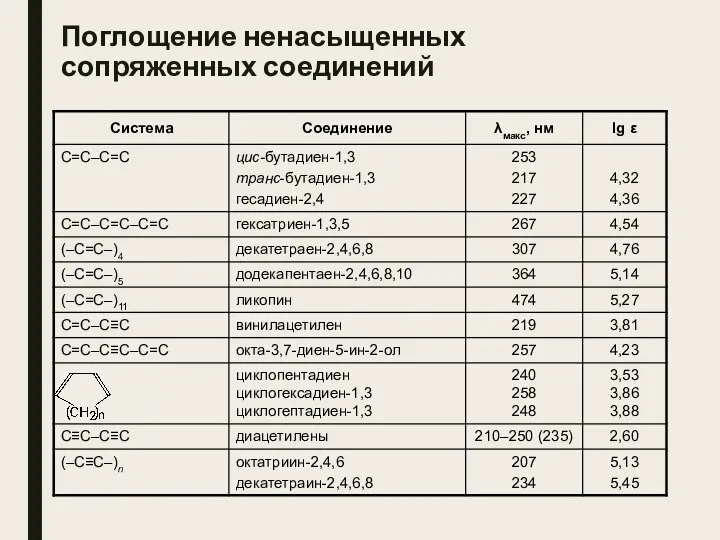
- 28. Поглощение ненасыщенных сопряженных соединений
- 29. Диены, полиены и полиины Определенное влияние на положение максимума поглощения в УФ-спектре сопряженных диенов оказывают алкильные
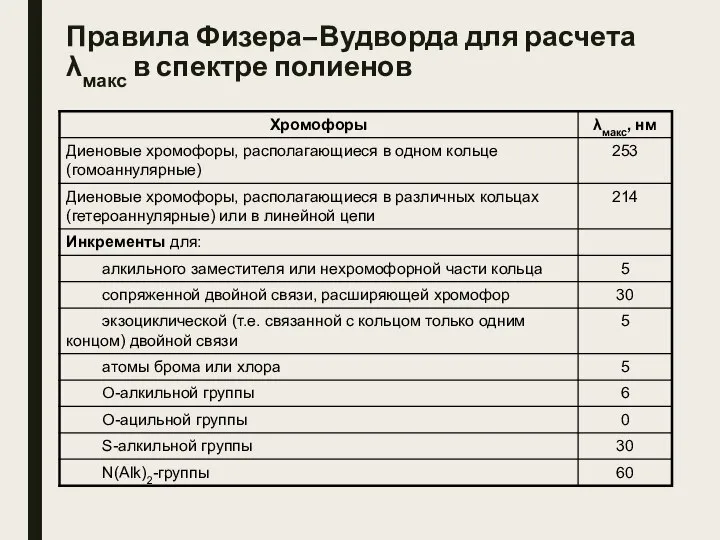
- 30. Правила Физера–Вудворда для расчета λмакс в спектре полиенов
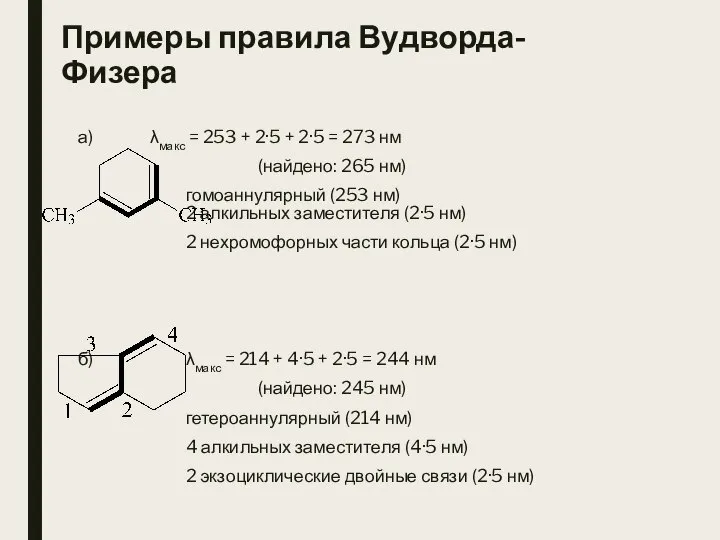
- 31. Примеры правила Вудворда-Физера а) λмакс = 253 + 2·5 + 2·5 = 273 нм (найдено: 265
- 32. Примеры правила Вудворда-Физера в) λмакс = 253 + 2·30 + 3·5 + 0 + 5·5 =
- 33. Диены, полиены и полиины Таким образом, УФ-спектр позволяет обнаружить в исследуемом веществе: диеновую систему; сделать определенные
- 34. Карбонильные соединения Группа С=О алифатических альдегидов и кетонов может поглощать УФ-излучение в виде 4-х полос: две
- 35. Карбонильные соединения Для УФ-спектров предельных карбонильных соединений характерна полоса λмакс 275–290 нм, соответствующая n→π*-переходу. Переход запрещен
- 36. Карбонильные соединения Для ациклических альдегидов (λмакс в гексане 290 нм) и кетонов (λмакс в гексане 279
- 38. Скачать презентацию





















 Действия электрического тока
Действия электрического тока Аттестационная работа. Методическая разработка проекта по физике на тему «Сила трения и движение»
Аттестационная работа. Методическая разработка проекта по физике на тему «Сила трения и движение» Контроль формы оптических поверхностей пробным стеклом, на интерферометре Физо и на неравноплечем лазерном интерферометре
Контроль формы оптических поверхностей пробным стеклом, на интерферометре Физо и на неравноплечем лазерном интерферометре Гамма-излучение
Гамма-излучение Альберт Эйнштейн
Альберт Эйнштейн Силы в природе
Силы в природе Тормозные системы с пневмоприводом
Тормозные системы с пневмоприводом Атомно-абсорбционная спектрометрия
Атомно-абсорбционная спектрометрия Исследование свойств магнита
Исследование свойств магнита Адсорбация ПАВ на границе раствор - газ
Адсорбация ПАВ на границе раствор - газ Поляризация света. Применение
Поляризация света. Применение Основные понятия и определения в электротехнике
Основные понятия и определения в электротехнике Скорость испарения зависит от рода жидкости. Вода(Жидкость на ватке высохла спустя 2 минуты, ватку сушили феном)
Скорость испарения зависит от рода жидкости. Вода(Жидкость на ватке высохла спустя 2 минуты, ватку сушили феном) Источники электроэнергии
Источники электроэнергии Электрический ток в различных средах. 10 класс
Электрический ток в различных средах. 10 класс Телеграф и перевернутая пирамида
Телеграф и перевернутая пирамида Кинематика точки. Способы задания движения. Уравнения движения. Траектория. Закон движения точки
Кинематика точки. Способы задания движения. Уравнения движения. Траектория. Закон движения точки Презентация Напряжение
Презентация Напряжение Биологиялық жүйелер люминесценциясы. (Дәріс 15)
Биологиялық жүйелер люминесценциясы. (Дәріс 15) Энергияның дәстүрден тыс коздері. Күн энергиясы немесе гелиоэнергетика
Энергияның дәстүрден тыс коздері. Күн энергиясы немесе гелиоэнергетика РЕОСТАТЫ материал к уроку физики в 8 классе учителя МКОУ «Касторенская СОШ №1» Ковтун Аллы Михайловны.
РЕОСТАТЫ материал к уроку физики в 8 классе учителя МКОУ «Касторенская СОШ №1» Ковтун Аллы Михайловны. Презентация по физике Механические колебания
Презентация по физике Механические колебания  Плавление и кристаллизация. Решение задач
Плавление и кристаллизация. Решение задач Физика. Границы применимости
Физика. Границы применимости Жидкостные лазеры
Жидкостные лазеры Министерство Образования и Науки РФ Муниципальное Общеобразовательное Учреждение Аксайская Средняя Общеобразовательная Школа
Министерство Образования и Науки РФ Муниципальное Общеобразовательное Учреждение Аксайская Средняя Общеобразовательная Школа  Решение задач на применение законов Ньютона
Решение задач на применение законов Ньютона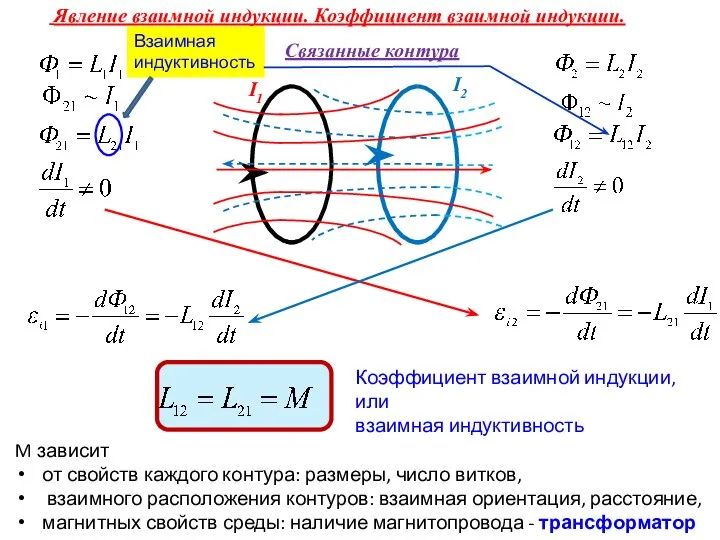 Явление взаимной индукции. Коэффициент взаимной индукции. Взаимная индуктивность
Явление взаимной индукции. Коэффициент взаимной индукции. Взаимная индуктивность