Содержание
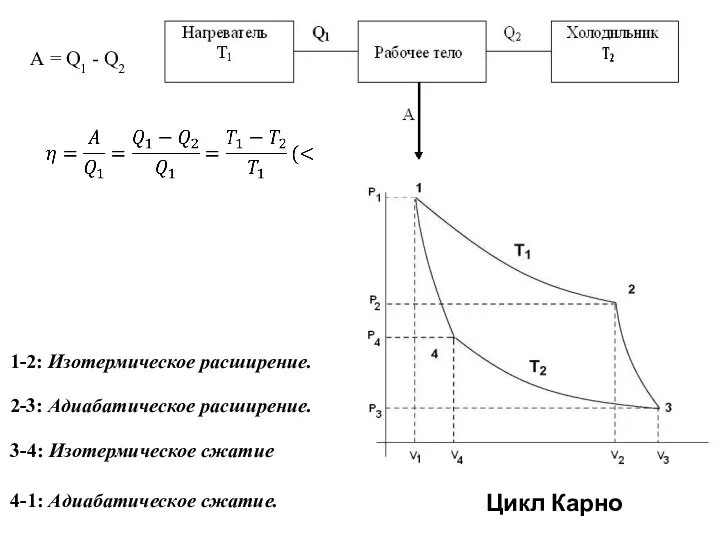
- 2. А = Q1 - Q2 2-3: Адиабатическое расширение. 3-4: Изотермическое сжатие 4-1: Адиабатическое сжатие. 1-2: Изотермическое
- 3. Теоремы Карно: КПД тепловой машины, работающей по циклу Карно не зависит от природы работающего тела, а
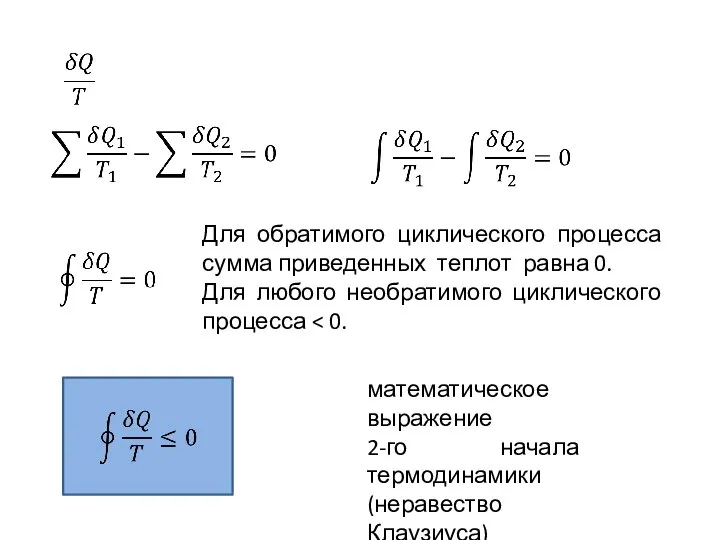
- 4. математическое выражение 2-го начала термодинамики (неравество Клаузиуса) Для обратимого циклического процесса сумма приведенных теплот равна 0.
- 5. Энтропия – функция состояния, приращение которой равно приведенной теплоте, полученной системой в обратимом изотермическом процессе. Изменение
- 6. Система стремится самопроизвольно перейти в состояние с максимальной термодинамической вероятностью. Энтропия данного количества вещества увеличивается по
- 7. в изолированных системах самопроизвольно могут протекать только процессы, сопровождающиеся увеличением энтропии При абсолютном нуле температуры свободная
- 8. Термодинамические потенциалы Н PV PV U F G TS TS Соотношения между функциями U, H, F
- 9. Экзотермические реакции; ΔH ΔS > 0 всегда протекают самопроизвольно. ΔS Эндотермические реакции; ΔH > 0. ΔS
- 10. Химическое равновесие Термодинамическое равновесие – термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во
- 11. Закон действующих масс (ЗДМ): константа равновесия химической реакции равна отношению произведений равновесных концентраций продуктов реакции в
- 12. Величина константы равновесия зависит от природы реагирующих веществ и температуры и не зависит от равновесных концентраций
- 13. Химический потенциал µi = µi0 + RTlnPi µi = µi0 + RTlnCi µi0 - стандартный химический
- 14. Уравнение изотермы Вант-Гоффа
- 15. Зависимость константы равновесия от температуры уравнение изобары Вант-Гоффа уравнение изохоры Вант-Гоффа для небольшого температурного интервала:
- 16. Принцип Ле-Шателье: если на систему, находящуюся в состоянии равновесия в изобарно-изотермических или изохорно-изотермических условиях оказать какое-либо
- 18. Скачать презентацию













 Стационарные процессы теплопроводности
Стационарные процессы теплопроводности Потери в электрических сетях
Потери в электрических сетях Презентация по физике "Роль компьютера в жизни человека" - скачать
Презентация по физике "Роль компьютера в жизни человека" - скачать  Тип подшипника. Схема установки подшипника на вал
Тип подшипника. Схема установки подшипника на вал Особенности химии, связанные с её физикализацией. Дифференциация и интеграция науки
Особенности химии, связанные с её физикализацией. Дифференциация и интеграция науки Эффективность топлива
Эффективность топлива Атом и атомное ядро
Атом и атомное ядро Деформация поликристаллов
Деформация поликристаллов Виды спектров. Спектральный анализ
Виды спектров. Спектральный анализ Введение в электротехнику
Введение в электротехнику Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц УРОК ФИЗИКИ В 10 КЛАССЕ Основные положения МКТ Учитель Кононов Геннадий Григорьевич СОШ № 29 Славянский район
УРОК ФИЗИКИ В 10 КЛАССЕ Основные положения МКТ Учитель Кононов Геннадий Григорьевич СОШ № 29 Славянский район  Применение ядерной энергии
Применение ядерной энергии Момент пары сил
Момент пары сил Первое начало термодинамики
Первое начало термодинамики Физико-математическая рыбалка
Физико-математическая рыбалка Виды технического обслуживания
Виды технического обслуживания УРОК ФИЗИКИ В 10 КЛАССЕ Взаимные превращения жидкостей и газов Учитель Кононов Геннадий Григорьевич СОШ № 29 Славянский ра
УРОК ФИЗИКИ В 10 КЛАССЕ Взаимные превращения жидкостей и газов Учитель Кононов Геннадий Григорьевич СОШ № 29 Славянский ра Умови рівноваги тіла
Умови рівноваги тіла Поширення електромагнітних хвиль над пласкою ідеально провідною поверхнею
Поширення електромагнітних хвиль над пласкою ідеально провідною поверхнею Экспериментальное исследование процессов солеотложения нефтепромысловом оборудовании при электромагнитном воздействии
Экспериментальное исследование процессов солеотложения нефтепромысловом оборудовании при электромагнитном воздействии Активная зона реактора ВВЭР-1200 (В-392М). Назначение и проектные основы
Активная зона реактора ВВЭР-1200 (В-392М). Назначение и проектные основы Измерительный прибор для определения влажности воздуха - гигрометр
Измерительный прибор для определения влажности воздуха - гигрометр Методы интенсификации гетерогенного процесса, протекающего в диффузионной области
Методы интенсификации гетерогенного процесса, протекающего в диффузионной области Термоэлекричество
Термоэлекричество Тепловое излучение
Тепловое излучение Намагничивание парамагнетиков и диамагнетиков. Соотношение между проявлением диа- и парамагнитных свойств вещества
Намагничивание парамагнетиков и диамагнетиков. Соотношение между проявлением диа- и парамагнитных свойств вещества Системы полного привода
Системы полного привода