11 класс Урок по теме Почему протекают химические реакции Составитель презентации – учитель химии МОУ СОШ им. А.С. Попова Иванова
Содержание
- 2. План урока. Закон сохранения массы и энергии. Тепловой эффект химической реакции. Экзотермические и эндотермические реакции. Термохимия.
- 3. Почему протекают химические реакции Закон сохранения массы и энергии. Масса веществ, вступающих в реакцию равна массе
- 4. Закон сохранения массы и энергии Взаимосвязь массы и энергии выражается уравнением Эйнштейна: E = mc2 где
- 5. Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты,
- 6. Тепловые эффекты химических реакций. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она
- 7. Классификация реакций
- 8. Реакции, протекающие с выделением теплоты, проявляют положительный тепловой эффект (Q>0, DH С(тв) + 2 H2(г) =
- 9. Тепловой эффект химической реакции Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами
- 11. Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ. Существует два важнейших закона термохимии.
- 12. закон Лавуазье–Лапласа Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
- 13. Второй закон термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом: Тепловой эффект реакции
- 14. Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH. Первый путь (одностадийный): 2 NaOH
- 15. Ученый, чьим именем назван основной закон термохимии, несколько лет работал врачом в Иркутске; по учебнику, написанному
- 17. Энтальпия это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании. Величина, характеризующая
- 18. Энтальпия и тепловой эффект противоположны по знаку При экзотермических реакциях, когда тепло выделяется, D Н отрицательно.
- 19. Как вычислить тепловой эффект реакции Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции
- 20. энтропия Функция характеризующая степень беспорядка DS Чем больше частиц в системе, тем больше в системе беспорядка
- 21. Выводы Всякая химическая реакция характеризуется двумя энергетическими характеристиками: энтальпией (DH) и энтропией (DS). Для самопроизвольных реакций
- 22. Задача 5 При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение
- 23. Домашнее задание Изучить материал учебника параграф 12, выполнить задания № 2.6; приготовить сообщение из дополнительной литературы,
- 25. Скачать презентацию






















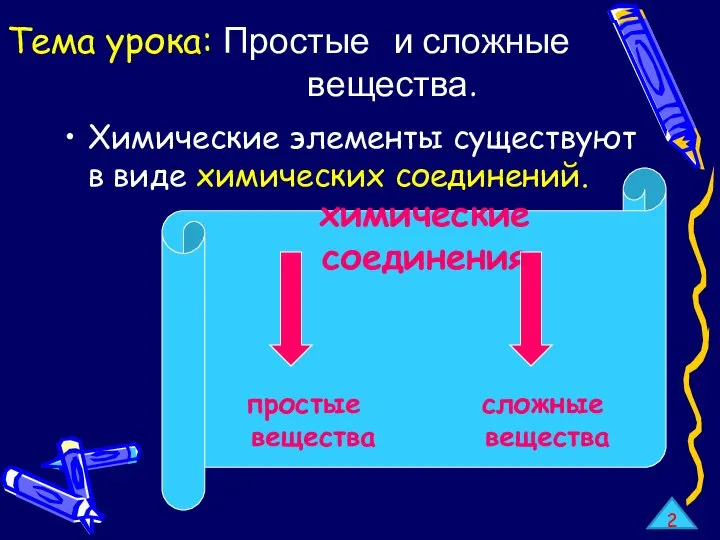 Простые и сложные вещества. Металлы и неметаллы. Бинарные соединения
Простые и сложные вещества. Металлы и неметаллы. Бинарные соединения Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха
Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха Полимерные материалы
Полимерные материалы Презентация по Химии "Сміття 1" - скачать смотреть
Презентация по Химии "Сміття 1" - скачать смотреть  Химический состав свежих плодов и овощей
Химический состав свежих плодов и овощей Готовимся к контрольной работе по химии
Готовимся к контрольной работе по химии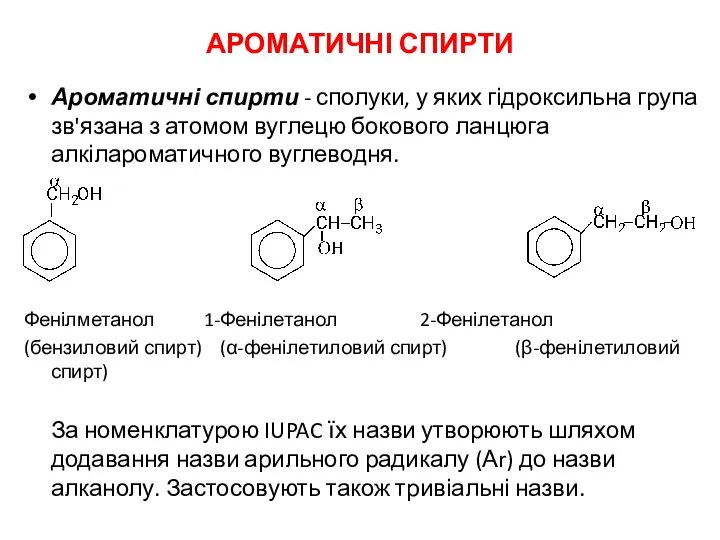 Ароматичні спирти
Ароматичні спирти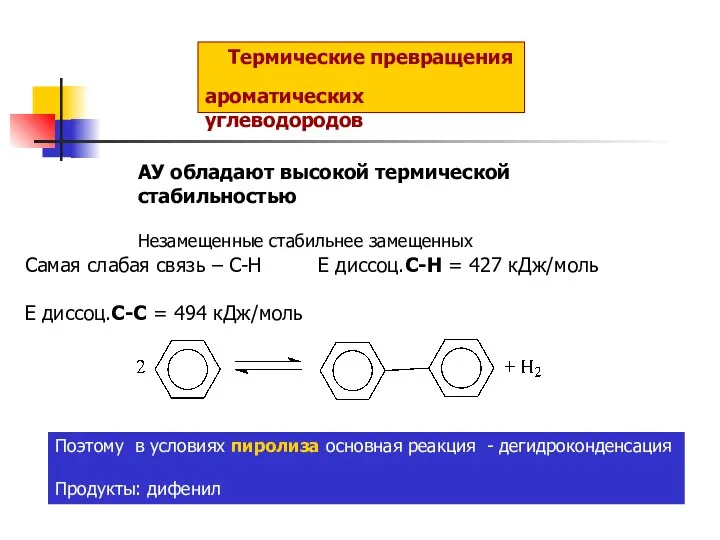 Термические превращения ароматических углеводородов
Термические превращения ароматических углеводородов Минералы натрия
Минералы натрия Алканы
Алканы Поверхностные явления. Лекция 15
Поверхностные явления. Лекция 15 Камни и Лев
Камни и Лев Гетерофункциональные органические соединения. Определение
Гетерофункциональные органические соединения. Определение Химическая посуда и ее значение (1)
Химическая посуда и ее значение (1) Материаловедение. Химические волокна (7 класс)
Материаловедение. Химические волокна (7 класс) Свойства растворов
Свойства растворов Аттестационная работа. Проектная и исследовательская деятельность как способ формирования химических знаний и умений
Аттестационная работа. Проектная и исследовательская деятельность как способ формирования химических знаний и умений Натуральный яблочный уксус
Натуральный яблочный уксус Губна помада та ії призначення
Губна помада та ії призначення Углерод. 9 класс
Углерод. 9 класс Электронная формула химических элементов
Электронная формула химических элементов Кислород. Характеристика и применение
Кислород. Характеристика и применение Строение соединений d-элементов
Строение соединений d-элементов Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі
Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі Обменные реакции в растворах электролитов
Обменные реакции в растворах электролитов Сложное вещество
Сложное вещество Cложные липиды (липоиды)
Cложные липиды (липоиды) Азот. Химические свойства азота
Азот. Химические свойства азота