Содержание
- 2. Кремний в виде кристаллов входит в состав горных пород образует бесцветные кристалла кварца и горного хрусталя
- 3. Кремний – кристаллическое вещество темно-серого цвета с металлическим блеском. Кристаллическая решетка кремния напоминает структуру алмаза.
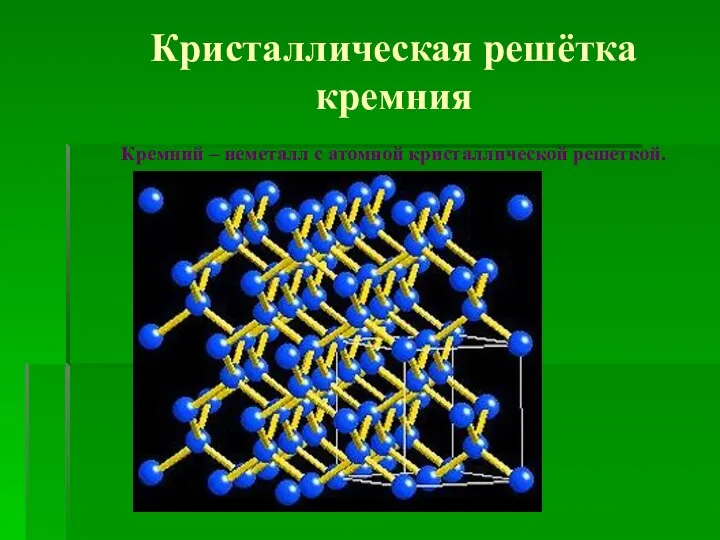
- 4. Кристаллическая решётка кремния Кремний – неметалл с атомной кристаллической решеткой.
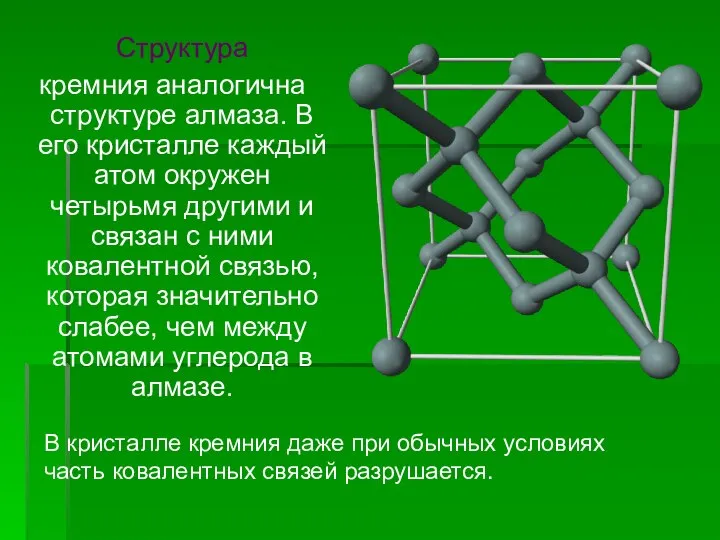
- 5. Структура кремния аналогична структуре алмаза. В его кристалле каждый атом окружен четырьмя другими и связан с
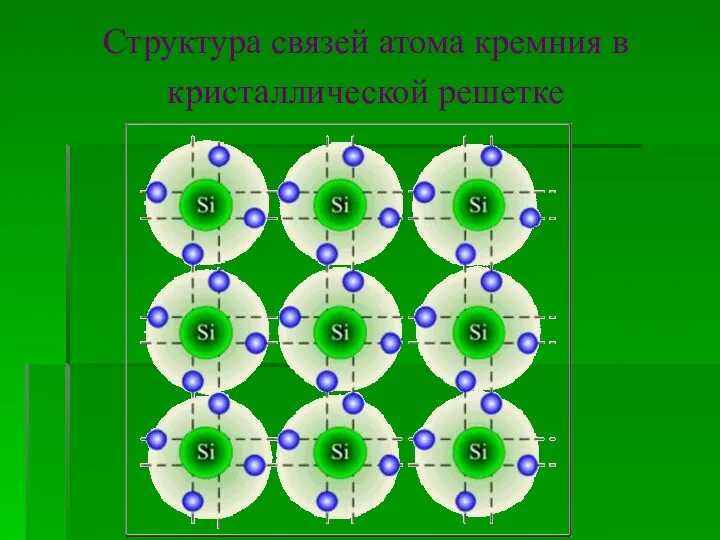
- 6. Структура связей атома кремния в кристаллической решетке
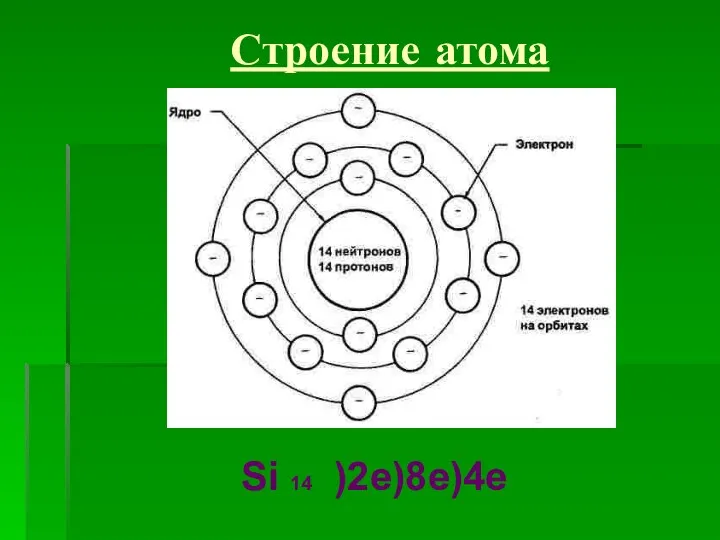
- 7. Строение атома Si 14 )2e)8e)4e
- 8. Соединения кремния 0 +4 +2 Примеры: Si, SiO2, SiO.
- 9. Физические свойства кремния Темно-серые, блестящие, непрозрачные кристаллы Хрупкий Твердый Тугоплавкий, Плохой проводник тока
- 10. Химические свойства кремния а) восстановительные 1) Si + O2 =SiO2 2) Si + 2CL2 = SiCL4
- 11. Методы получения кремния В промышленности кремний получают восстановлением кремнезема SiO2 коксом в электрических печах при 1500-17000С:
- 12. Применение кремния материал для электроники материал для сосудов; компонент сплавов с железом; - сверхчистый кремний –
- 13. Соединения кремния 1. Оксид кремния (IV) Оксид кремния SiO2 (IV) называют также кремнеземом. Физические свойства: бесцветное,
- 14. Модификации кремнезёма (кварца) кристаллический кремнезем — в виде минерала кварца и его разновидностей (горный хрусталь, халцедон,
- 15. Кварц – SiO2 кристаллическая модификация Кварцевое стекло - SiO2 Аморфная модификация
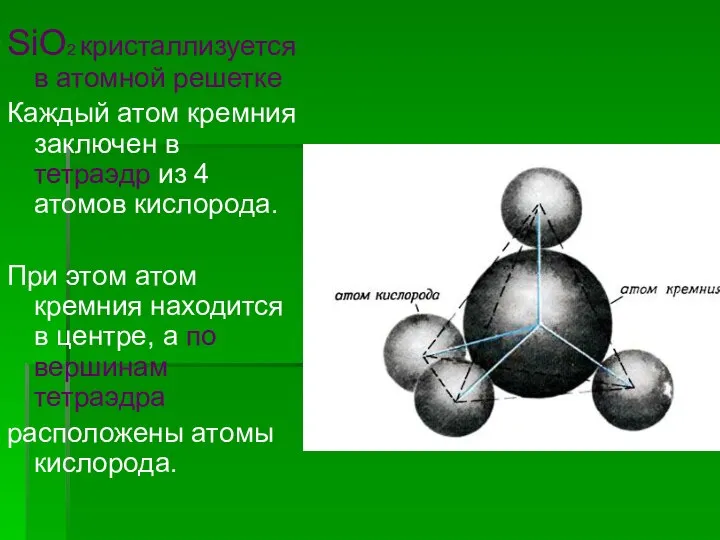
- 16. SiO2 кристаллизуется в атомной решетке Каждый атом кремния заключен в тетраэдр из 4 атомов кислорода. При
- 17. Весь кусок кремнезема SiO2 можно рассматривать как кристалл, формула которого (SiO2)n. Такое строение оксида кремния (IV)
- 18. Химические свойства оксида кремния (IV) Относится к кислотным оксидам: 1. При сплавлении его с твердыми щелочами,
- 19. 2. Реагирует со щелочами в растворе (образует ортосиликаты). Кип. SiO2 (ам.)+ 4NaOH?Na4SiO4+ 2H2O 3. Взаимодействует только
- 20. 4. Восстанавливается углеродом, магнием, железом (в доменном процессе). Кип а) SiO2 + 3C(кокс)?SiC+CO б)SiO2 + 2Mg?Si+
- 21. Кремневые кислоты H2SiO3 — кислота очень слабая, в воде мало растворима. Состав кремниевых кислот представляют в
- 22. Силикаты Силикаты – химические соединения, содержащие кремнекислотные остатки различного состава [SinOm]. Основа всех силикатов - кремнекислородный
- 23. Применение силикатов в качестве жидкого стекла - концентрированных растворов силикатов калия и натрия; его используют: а)
- 25. Скачать презентацию















![Силикаты Силикаты – химические соединения, содержащие кремнекислотные остатки различного состава [SinOm].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1187783/slide-21.jpg)

 Презентация по Химии "Правила безопасности труда в кабинете химии" - скачать смотреть
Презентация по Химии "Правила безопасности труда в кабинете химии" - скачать смотреть  Синтез в неводных средах
Синтез в неводных средах Амиды кислот. Азо- и диазосоединения
Амиды кислот. Азо- и диазосоединения Полиимиды: синтез, свойства и применение. Полиимидоамиды, полиимидоэфиры
Полиимиды: синтез, свойства и применение. Полиимидоамиды, полиимидоэфиры Класс органических соединений фенолы
Класс органических соединений фенолы Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша) Моделирование химико-технологической системы. Эмпирические, физические, математические методы моделирования
Моделирование химико-технологической системы. Эмпирические, физические, математические методы моделирования Презентация по Химии "Железо" - скачать смотреть
Презентация по Химии "Железо" - скачать смотреть  Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Основы безопасности при уничтожении химического оружия
Основы безопасности при уничтожении химического оружия Общие способы получения металлов
Общие способы получения металлов Полиэтилен, свойства и применение
Полиэтилен, свойства и применение Дисперсные системы
Дисперсные системы Жири як компоненти їжі. Їхня роль в організмі
Жири як компоненти їжі. Їхня роль в організмі  Способы выращивания кристаллов (лекция 3)
Способы выращивания кристаллов (лекция 3) Атмосфера. Химические и физико-химические процессы в атмосфере
Атмосфера. Химические и физико-химические процессы в атмосфере Горные породы и минералы. Камни-самоцветы
Горные породы и минералы. Камни-самоцветы Химические свойства насыщенных одноатомных спиртов
Химические свойства насыщенных одноатомных спиртов Композитные материалы. Технология. 7 класс
Композитные материалы. Технология. 7 класс Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония
Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика
Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика Промышленное получение аминокислот и их применение в медицине и диетологии
Промышленное получение аминокислот и их применение в медицине и диетологии Углеводы. Глюкоза. Простые эфиры. Димедрол
Углеводы. Глюкоза. Простые эфиры. Димедрол Сложные реакции
Сложные реакции Кислородные соединения азота
Кислородные соединения азота Геохимические процессы в литосфере Земли и геобаротермометрия
Геохимические процессы в литосфере Земли и геобаротермометрия Метаболизм - обмен веществ
Метаболизм - обмен веществ Кислотность и основность рганических соединений. Инфракрасная спектроскопия
Кислотность и основность рганических соединений. Инфракрасная спектроскопия