Содержание
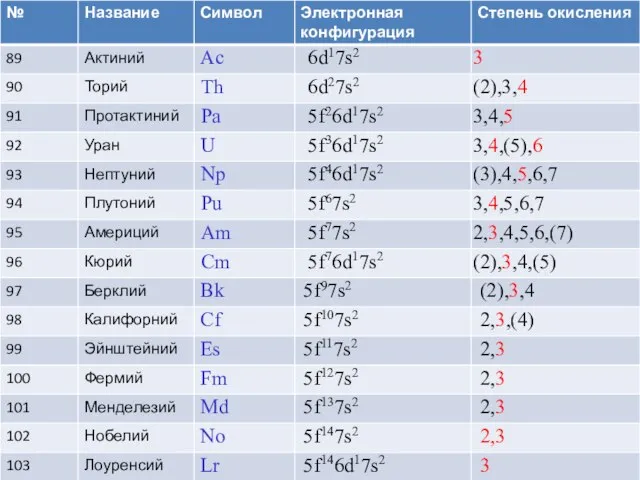
- 2. f-металлы Актиниды: химически очень разнообразны, с.о. от +2 до +7 Все актиноиды являются радиоактивными т.е. у
- 3. Заполняется f-подуровень 5-го периода Близость 5f и 6d орбиталей обеспечивает легкость перехода электронов между ними Элементы
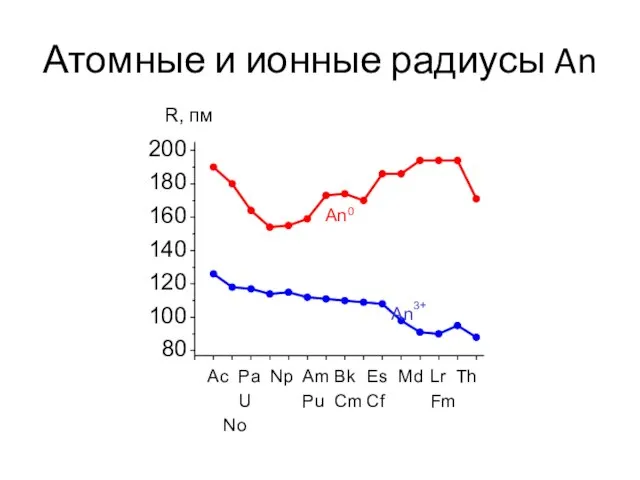
- 5. Атомные и ионные радиусы An 200 180 160 140 120 100 80 An0 An3+ Ac Pa
- 6. Физические свойства Все они мягкие, серебристого цвета, темнеют на воздухе, обладают высокой плотностью и пластичностью. Некоторые
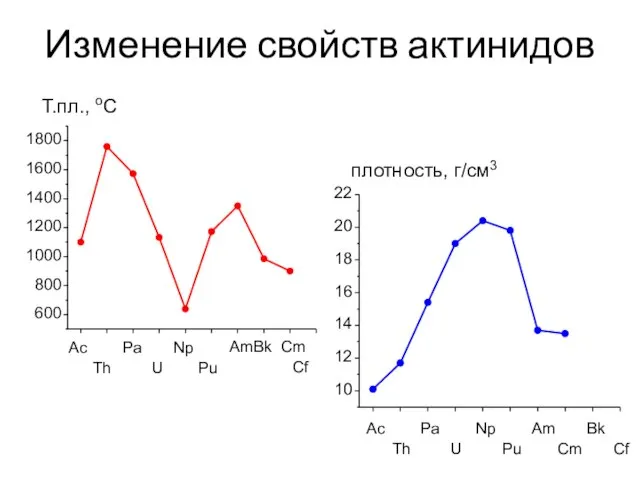
- 7. Изменение свойств актинидов 1800 1600 1400 1200 1000 800 600 22 20 18 16 14 12
- 8. Химические свойства Все металлы растворяются в кислотах. Только актиний растворяется в воде: 2Ac + 6H2O =
- 9. Получение актинидов Только Th и U получают химическими методами Остальные элементы получают в результате ядерного синтеза
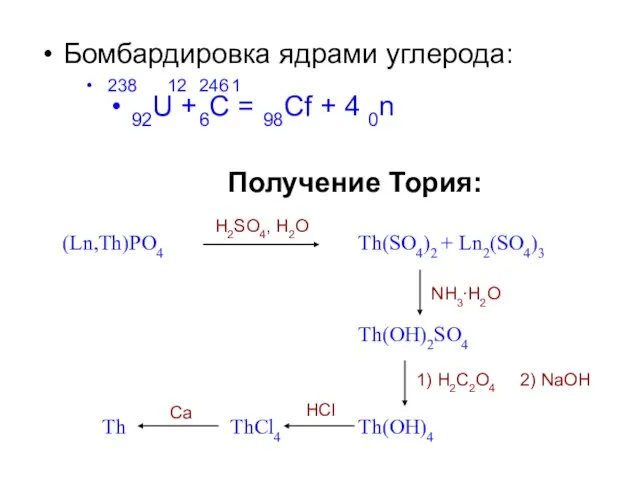
- 10. Бомбардировка ядрами углерода: 238 12 246 1 92U + 6C = 98Cf + 4 0n Получение
- 11. Получение Урана U3O8 Na4[UO2(CO3)3] Na4[UO2(CO3)3] (NH4)2U2O7 (NH4)2U2O7 UO2 UF4 UF4 + 2Mg = 2MgF2 + U
- 12. Основные минералы карнотит K2O⋅2UO3⋅V2O5⋅3H2O урановая смолка U3O8 монацит (Ln,Th)PO4 торит Th(SiO4)2
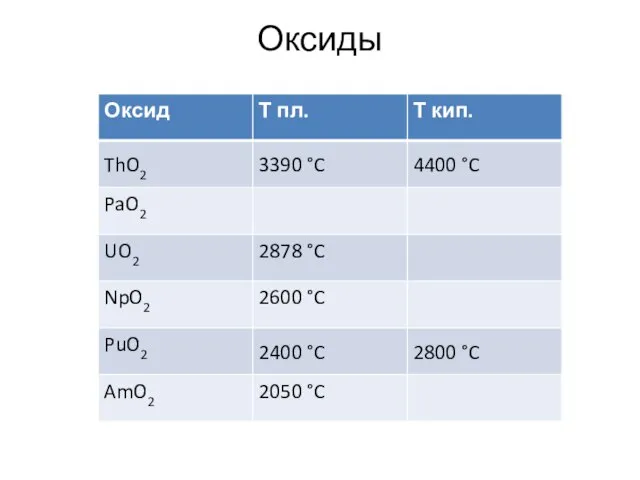
- 13. Оксиды
- 14. Получение оксидов Th(OH)4 = ThO2 + 2H2O 3U + 4O2 = U3O8 U + 2H2O =
- 15. Гидроксиды Th(OH)4 = ThO2 + 2H2O ThCl4 + 4NH3·H2O = Th(OH)4↓ + 4NH4Cl Th(OH)4 + 4HNO3
- 16. Химия тория Реагирует с кислотами Th + 4HCl = ThCl4 + 2H2 Th + HNO3 (конц)
- 17. 1. Оксид тугоплавок Т.пл. = 3220 оС Th(OH)4 = ThO2 + 2H2O 2. Гидроксид ThIV нерастворим
- 18. Химия урана 1. Уран – активный металл медленно при н.у. выше 200 оС бурно (to) 3U
- 19. Различия лантанидов и актинидов Актиниды не имеют стабильных изотопов 4f-орбитали не принимают участия в ковалентной связи,
- 21. Скачать презентацию





![Получение Урана U3O8 Na4[UO2(CO3)3] Na4[UO2(CO3)3] (NH4)2U2O7 (NH4)2U2O7 UO2 UF4 UF4 +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/548328/slide-10.jpg)







 Химия повсюду окружает человека
Химия повсюду окружает человека Basis Sets and Pseudopotentials
Basis Sets and Pseudopotentials Основні поняття хімічної термодинаміки
Основні поняття хімічної термодинаміки Физические свойства металлов: пластичность, электропроводность, теплопроводность, металлический блеск, плотность
Физические свойства металлов: пластичность, электропроводность, теплопроводность, металлический блеск, плотность ОГЭ №2, вопрос 1-16
ОГЭ №2, вопрос 1-16 Сероводород, сернистый водород
Сероводород, сернистый водород Мышьяк (лат. аrsenicum)
Мышьяк (лат. аrsenicum) Реакции разложения
Реакции разложения Строение атома. (Лекция 2-3)
Строение атома. (Лекция 2-3) Области применения спиртов
Области применения спиртов Строение атома. Химическая связь
Строение атома. Химическая связь ОГЭ химия 2021 задание 13
ОГЭ химия 2021 задание 13 Неделя специальности "Аналитический контроль качества химических соединений"
Неделя специальности "Аналитический контроль качества химических соединений" Производство фенолформальдегидной смолы
Производство фенолформальдегидной смолы Iodine
Iodine Презентация по Химии "Химия и сельское хозяйство. Пестициды" - скачать смотреть
Презентация по Химии "Химия и сельское хозяйство. Пестициды" - скачать смотреть  Внесение удобрений разбрасыванием
Внесение удобрений разбрасыванием Материаловедение. Свойства материалов. (Тема 2)
Материаловедение. Свойства материалов. (Тема 2) Карбоновые кислоты. Модели молекул
Карбоновые кислоты. Модели молекул Минерал клинохлор. Месторождения
Минерал клинохлор. Месторождения Ферментные препараты
Ферментные препараты Группы сходных химических элементов
Группы сходных химических элементов Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Металдарға қандай физикалық қасиеттер тән?
Металдарға қандай физикалық қасиеттер тән? Полимеры. Каучуки. Резина
Полимеры. Каучуки. Резина Ионная связь
Ионная связь Каталитический крекинг
Каталитический крекинг Бронза. Свойства
Бронза. Свойства