Содержание
- 2. Процесс каталитического крекинга является одним из наиболее распространенных процессов углубленной переработки нефти. На сегодняшний день процесс
- 3. Сжиженные газы каталитического крекинга применяют как сырье для получения высокооктановых компонентов изомерного строения, а также метилтретбутилового
- 4. Наилучшим сырьем для каталитического крекинга по выходу целевых продуктов (бензинов и сжиженных газов) является сырье с
- 5. Катализаторы каталитического крекинга Катализаторы каталитического крекинга представляют собой сложные многокомпонентные системы, состоящие из: матрицы-носителя; активного компонента
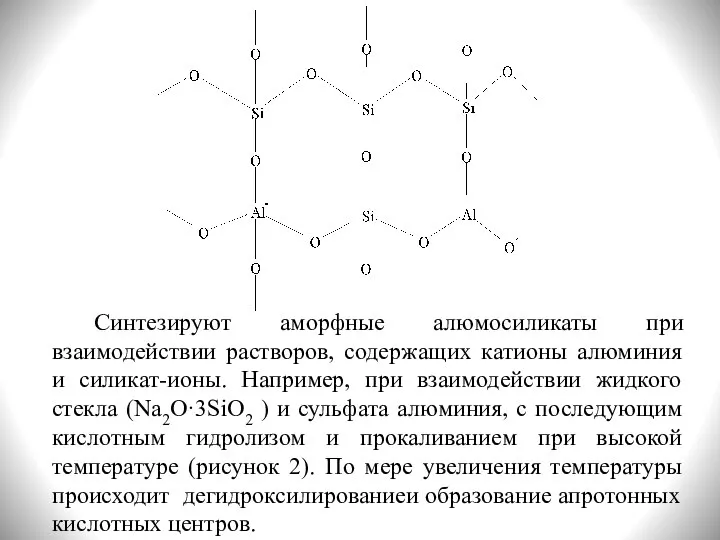
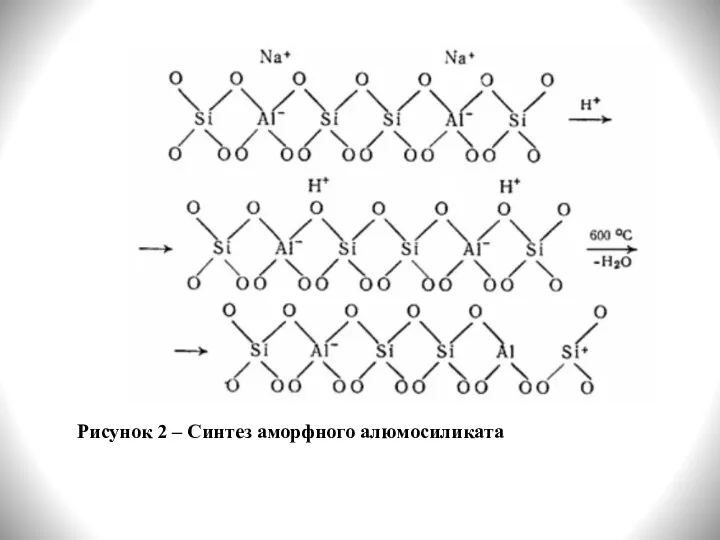
- 6. Синтезируют аморфные алюмосиликаты при взаимодействии растворов, содержащих катионы алюминия и силикат-ионы. Например, при взаимодействии жидкого стекла
- 7. Рисунок 2 – Синтез аморфного алюмосиликата
- 8. Химический состав алюмосиликатного катализатора рассматривают как смесь оксида алюминия и оксида кремия в составе кристаллогидрата: nAl2O3·mSiO2
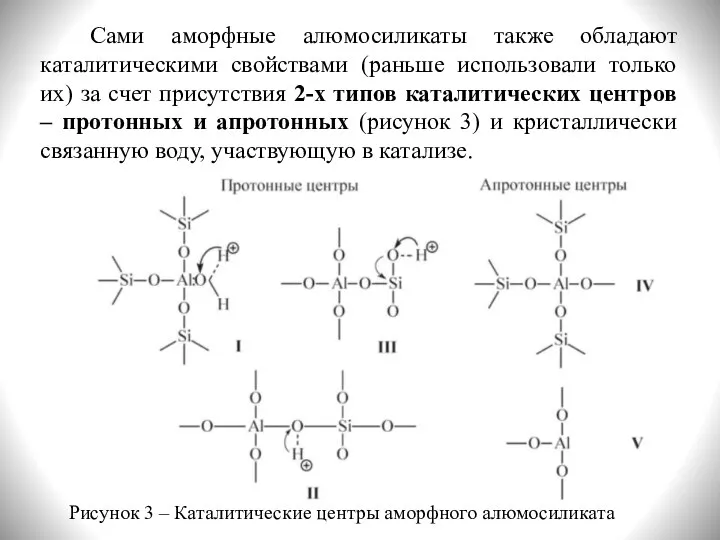
- 9. Сами аморфные алюмосиликаты также обладают каталитическими свойствами (раньше использовали только их) за счет присутствия 2-х типов
- 10. С участием протонных центров алюмосиликатных катализаторов катализ осуществляется подвижными протонами гидроксильных групп или кристаллизационной воды. Эти
- 11. Цеолиты в отличие от аморфных алюмосиликатов характеризуются: малым размером пор (от 3 до 10 Ǻ); в
- 12. Структура цеолита подобна структуре аморфного алюмосиликата (тоже с множеством полостей, «окон» и каналов), но характеризуется гораздо
- 13. Рисунок 4 – строение цеолитов: а – тетраэдрическая единица; б – содалитовая клетка; в – суперклетка;
- 14. В чистом виде цеолиты не могут применяться как катализаторы, поскольку размер пор очень мал, а крекинг
- 15. К первой группе относят коксогенные примеси (асфальтены, карбены, смолы) – эти вещества в условиях высокотемпературных процессов
- 16. Азот в составе азотистых оснований (анилина, пиридина, холина) нейтрализует кислотные центры катализатора, связываясь с ними. Обжигом
- 17. Схемы превращения углеводородов в условиях каталитического крекинга Парафины Олефин + Парафин Олефин + Н2 Изопарафины Нафтены
- 18. Механизмы превращений Превращения алканов Механизм карбокатионный: т.е. гетеролиз С-Н связи при участии протонных центров катализатора. I
- 19. II Реакции карбокатионов а) β-распад б) диспропорционирование в) перенос реакционного центра Склонность к β-распаду снижается от
- 20. г) изомеризация Тепло, выделяющееся в результате изомеризации при участии С-Н связи, затрачивается на образование сигма-комплекса при
- 21. Таким образом, в процессе каталитического крекинга образуются изоалканы, а также преимущественно вторичные и третичные карбокатионы, образующие
- 22. II Реакции циклических катионов Образующийся алкенильный ион легко изомеризуетс я в ион аллильного типа 1) С
- 23. Далее циклоалкены крекируются до аренов Непредельные нафтены крекируются быстрее насыщенных, и реакция идет до образования ароматических
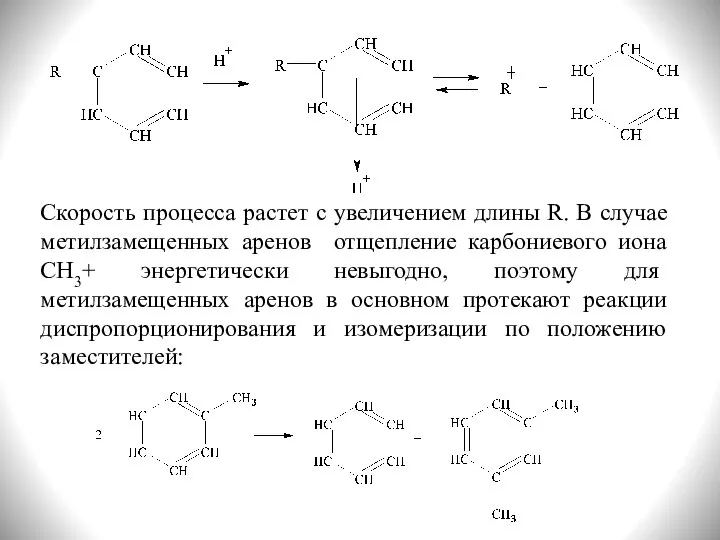
- 24. Скорость процесса растет с увеличением длины R. В случае метилзамещенных аренов отщепление карбониевого иона CH3+ энергетически
- 26. Скачать презентацию



















 Йод. Положение в периодической системе
Йод. Положение в периодической системе Композиты. Полимерные композиционные материалы
Композиты. Полимерные композиционные материалы Углерод. Металлы. 9 класс
Углерод. Металлы. 9 класс Термодинамические возможности получения меди с применением программного комплекса АСТРА-4
Термодинамические возможности получения меди с применением программного комплекса АСТРА-4 Презентация по Химии "мінеральні добрива." - скачать смотреть бесплатно_
Презентация по Химии "мінеральні добрива." - скачать смотреть бесплатно_ Етанол (етиловий спирт, винний спирт)
Етанол (етиловий спирт, винний спирт) Органічні сполуки в побуті Виконав Учень 11-Т класу ЗОШ №1 Новак Сергій
Органічні сполуки в побуті Виконав Учень 11-Т класу ЗОШ №1 Новак Сергій  Производство серной кислоты
Производство серной кислоты Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Radiation dosimetry
Radiation dosimetry Строение атома
Строение атома Общенаучные методы исследований
Общенаучные методы исследований Закономерности адсорбции ионов и адагуляции коллоидных частиц. Самосборка на поверхности. (Лекция 9)
Закономерности адсорбции ионов и адагуляции коллоидных частиц. Самосборка на поверхности. (Лекция 9) Строение атома. Движение электрона в атоме
Строение атома. Движение электрона в атоме КИСЛОРОД
КИСЛОРОД  Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Робота учениці 11 – А класу Каплун Ірини
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Робота учениці 11 – А класу Каплун Ірини  Кислотность и основность рганических соединений. Инфракрасная спектроскопия
Кислотность и основность рганических соединений. Инфракрасная спектроскопия Изомерия. Типы изомерии
Изомерия. Типы изомерии Презентация по Химии "Органическая химия" - скачать смотреть бесплатно
Презентация по Химии "Органическая химия" - скачать смотреть бесплатно Алкины. Способы получения
Алкины. Способы получения Уголь. Виды угля
Уголь. Виды угля Щелочные металлы
Щелочные металлы Обмен липидов
Обмен липидов Композиционные материалы – материалы будущего
Композиционные материалы – материалы будущего Методы экстрагирования ЛРС и оборудование
Методы экстрагирования ЛРС и оборудование Alkanes. A “family” of hydrocarbons
Alkanes. A “family” of hydrocarbons Презентация тест по химии
Презентация тест по химии Презентация по Химии "Медь." - скачать смотреть бесплатно
Презентация по Химии "Медь." - скачать смотреть бесплатно