Содержание
- 2. Строение алканов Алканы имеют два типа связей С-С и С-Н С-С ковалентная неполярная, С-Н ковалентная слабополярная
- 3. Гомологический ряд Метан СН4 Из этого следует , что Этан С2Н6 общая формула Пропан С3Н8 алканов
- 4. Изомерия Изомеры – это вещества одинакового качественного и количественного состава, но разные по строению. Алканам присуща
- 5. Физические свойства Алканы с количеством атомов углерода до 4 включительно – газы С количеством 5-10 атомов
- 6. Химические свойства 1) Крекинг – процесс термического разложения углеводорода, при котором происходит разрыв связей С-С ,
- 7. Химические свойства 2) Изомеризация – это процесс , при котором алканы нормального строения превращаются в алканы
- 8. Химические свойства 3) Дегидрирование – это процесс отщепления водорода под действием катализаторов. Пример: СН3-СН3 СН2 СН2
- 9. Химические свойства 4) Окисление. Пример: СН4 + 2О2 = СО2 + 2Н2О
- 10. Химические свойства 5) Замещение : Галогенирование – реакция замещения одного и более атомов водорода в молекуле
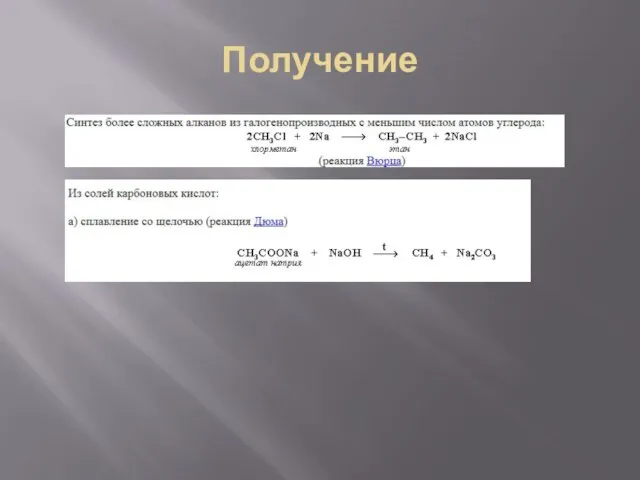
- 11. Получение 1) Крекинг нефти 2) Гидрирование непредельных углеводородов 3) Из синтез-газа ( СО+Н2) 4) Синтез более
- 12. Получение
- 13. Применение
- 14. Задание
- 16. Скачать презентацию












 Алюміній оксид Al2O3
Алюміній оксид Al2O3  Гетероциклические соединения
Гетероциклические соединения Красители: натуральные или искусственные?
Красители: натуральные или искусственные? Строение и функция белков
Строение и функция белков Эндоскопические методы гемостаза
Эндоскопические методы гемостаза Азолы. Гетероциклы с двумя гетероатомами
Азолы. Гетероциклы с двумя гетероатомами Предельные углеводороды ( по химии для учащихся 9 класса)
Предельные углеводороды ( по химии для учащихся 9 класса) Электрохимические методы анализа. Лекция 3
Электрохимические методы анализа. Лекция 3 Химия в разных науках
Химия в разных науках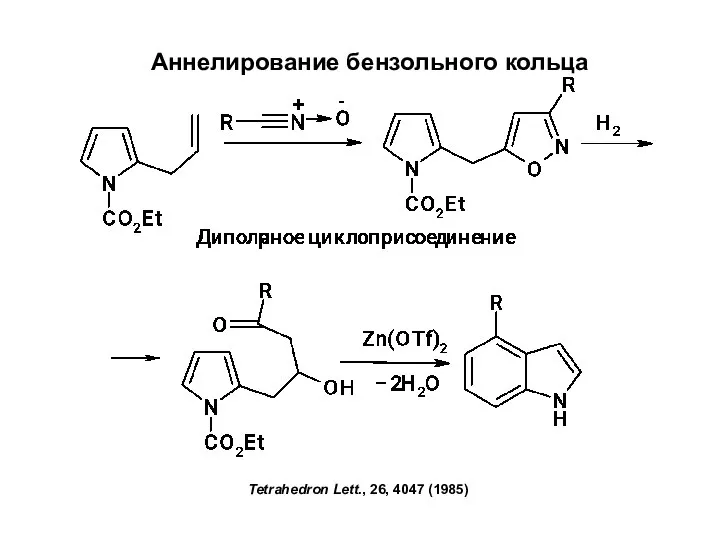 Аннелирование бензольного кольца
Аннелирование бензольного кольца Строение металлов
Строение металлов Нафта, склад, особливості залягання Підготувала учениця 2 курсу природничого класу Ніжинського ліцею ніжинської міської ради
Нафта, склад, особливості залягання Підготувала учениця 2 курсу природничого класу Ніжинського ліцею ніжинської міської ради  Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Видатні вітчизняні хіміки
Видатні вітчизняні хіміки Термохимия. Типы энтальпии
Термохимия. Типы энтальпии Презентация по химии ПЕПТИДЫ и Белки
Презентация по химии ПЕПТИДЫ и Белки  ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Презентация по Химии "азотная кислота" - скачать смотреть бесплатно
Презентация по Химии "азотная кислота" - скачать смотреть бесплатно Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти
Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти Презентация по Химии "Презентация Золото" - скачать смотреть
Презентация по Химии "Презентация Золото" - скачать смотреть  Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна
Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна  Расчет концентрационных пределов воспламенения жидкости
Расчет концентрационных пределов воспламенения жидкости Решение экспериментальных задач по теме металлы
Решение экспериментальных задач по теме металлы Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»
Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»  Стадии и общая схема почвообразования
Стадии и общая схема почвообразования Аттестационная работа. Окраска ткани природными красителями
Аттестационная работа. Окраска ткани природными красителями Химия в содружестве с другими науками
Химия в содружестве с другими науками