Содержание
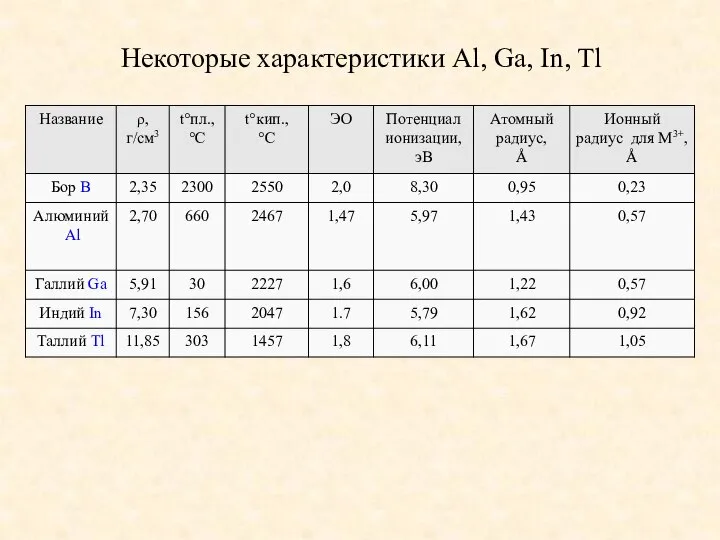
- 2. Некоторые характеристики Al, Ga, In, Tl
- 3. Особенности химии Al и элементов подгруппы Ga - Металлическая природа простых веществ. - Устойчивость только двух
- 4. Особенности химии Al и элементов подгруппы Ga (продолжение) - Особое положение Ga и Tl; (d и
- 5. Окисление амальгамированного алюминия
- 6. Особенности химии Al и элементов подгруппы Ga (продолжение) - Комплексообразование с лигандами малых размеров (OH-, F-
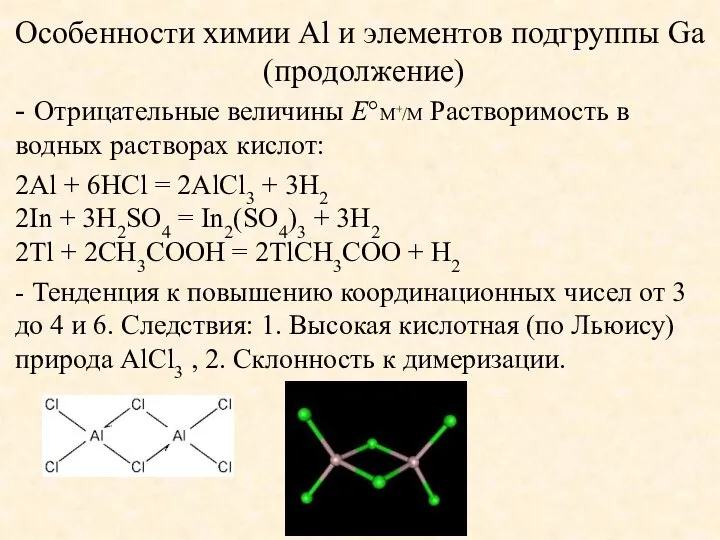
- 7. Особенности химии Al и элементов подгруппы Ga (продолжение) - Отрицательные величины E°M+/M Растворимость в водных растворах
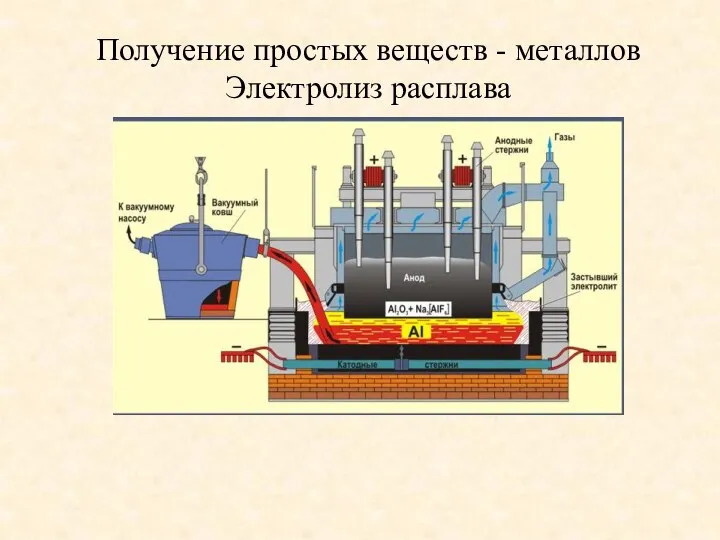
- 8. Получение простых веществ - металлов Электролиз расплава
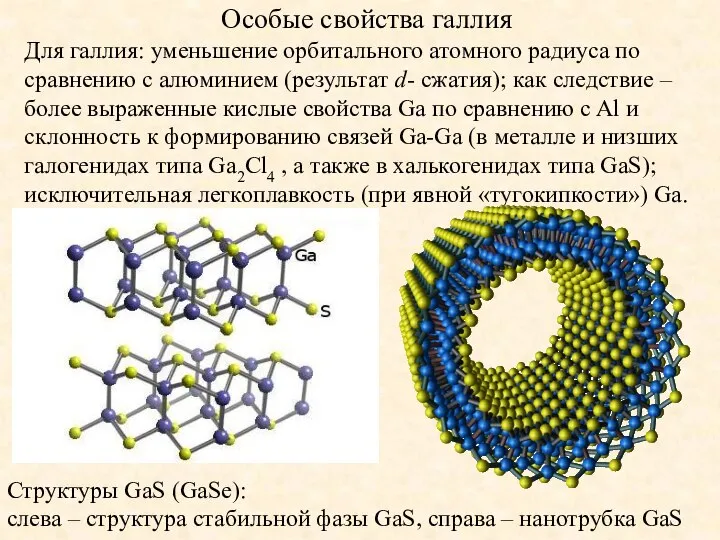
- 9. Особые свойства галлия Для галлия: уменьшение орбитального атомного радиуса по сравнению с алюминием (результат d- сжатия);
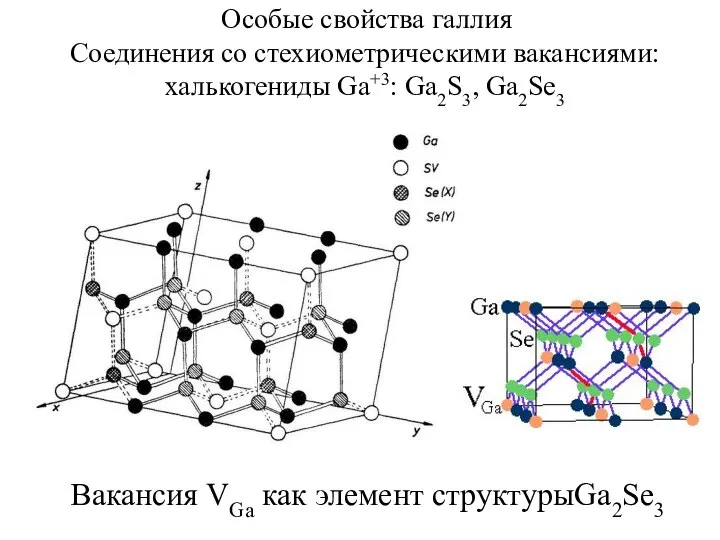
- 10. Особые свойства галлия Соединения со стехиометрическими вакансиями: халькогениды Ga+3: Ga2S3, Ga2Se3 Вакансия VGa как элемент структурыGa2Se3
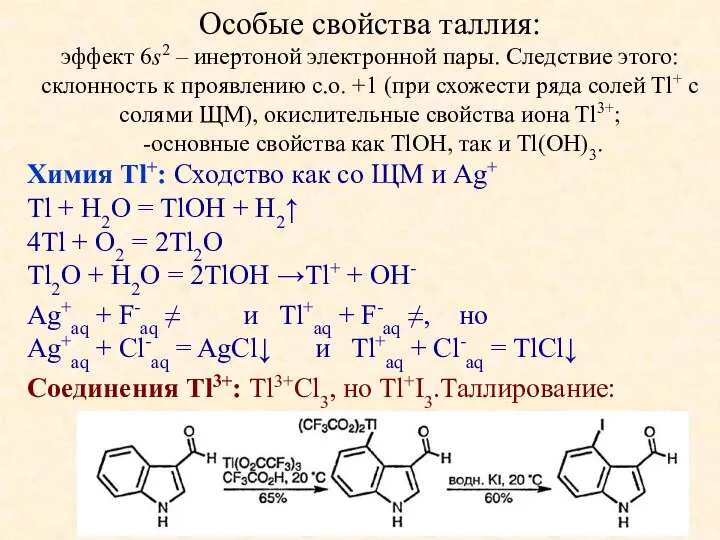
- 11. Особые свойства таллия: эффект 6s2 – инертоной электронной пары. Следствие этого: склонность к проявлению с.о. +1
- 13. Скачать презентацию




 Алюміній оксид Al2O3
Алюміній оксид Al2O3  Гетероциклические соединения
Гетероциклические соединения Красители: натуральные или искусственные?
Красители: натуральные или искусственные? Строение и функция белков
Строение и функция белков Эндоскопические методы гемостаза
Эндоскопические методы гемостаза Азолы. Гетероциклы с двумя гетероатомами
Азолы. Гетероциклы с двумя гетероатомами Предельные углеводороды ( по химии для учащихся 9 класса)
Предельные углеводороды ( по химии для учащихся 9 класса) Электрохимические методы анализа. Лекция 3
Электрохимические методы анализа. Лекция 3 Химия в разных науках
Химия в разных науках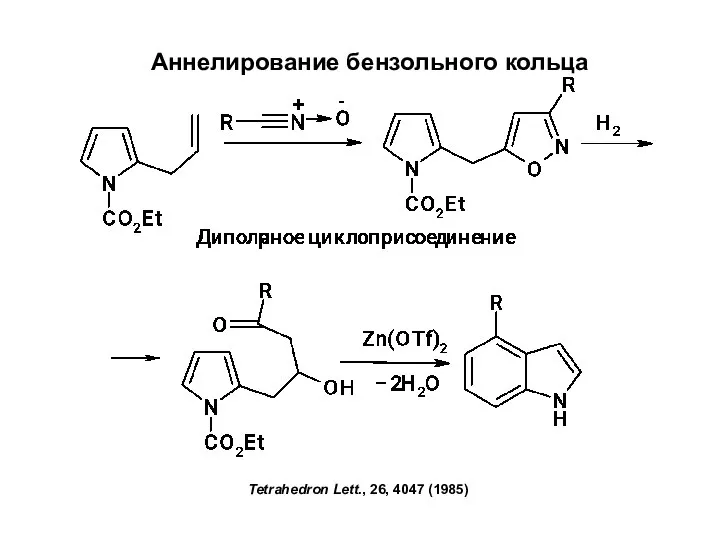 Аннелирование бензольного кольца
Аннелирование бензольного кольца Строение металлов
Строение металлов Нафта, склад, особливості залягання Підготувала учениця 2 курсу природничого класу Ніжинського ліцею ніжинської міської ради
Нафта, склад, особливості залягання Підготувала учениця 2 курсу природничого класу Ніжинського ліцею ніжинської міської ради  Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Видатні вітчизняні хіміки
Видатні вітчизняні хіміки Термохимия. Типы энтальпии
Термохимия. Типы энтальпии Презентация по химии ПЕПТИДЫ и Белки
Презентация по химии ПЕПТИДЫ и Белки  ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ Методы исследования гидрохимического режима водоемов
Методы исследования гидрохимического режима водоемов Презентация по Химии "азотная кислота" - скачать смотреть бесплатно
Презентация по Химии "азотная кислота" - скачать смотреть бесплатно Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти
Программа повышения квалификации. Каталитические процессы в глубокой переработке нефти Презентация по Химии "Презентация Золото" - скачать смотреть
Презентация по Химии "Презентация Золото" - скачать смотреть  Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна
Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна  Расчет концентрационных пределов воспламенения жидкости
Расчет концентрационных пределов воспламенения жидкости Решение экспериментальных задач по теме металлы
Решение экспериментальных задач по теме металлы Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»
Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»  Стадии и общая схема почвообразования
Стадии и общая схема почвообразования Аттестационная работа. Окраска ткани природными красителями
Аттестационная работа. Окраска ткани природными красителями Химия в содружестве с другими науками
Химия в содружестве с другими науками