Содержание
- 2. Al 13 Алюминий (лат. (лат. Aluminium(лат. Aluminium) 3 8 2 26,9815 3s2 3p1
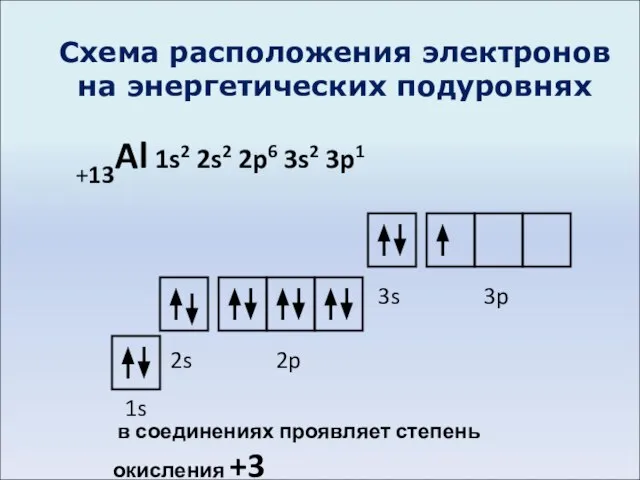
- 3. Схема расположения электронов на энергетических подуровнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s
- 4. Al – типичный металл Восстановительные свойства Al 0- 3ē Al+3 Тип химической связи -металлическая Тип кристаллической
- 5. Физические свойства Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает хорошей
- 6. Особенности физических и химических свойств алюминия, его нахождения в природе и применения: Алюминий – самый распространенный
- 7. Химические свойства
- 8. Алюминий реагирует с простыми веществами - неметаллами 4Al+3O2 = 2Al2O3 Поверхность покрывается пленкой оксида, в мелкораздробленном
- 9. Алюминий реагирует со сложными веществами: Алюминий растворяется в растворах кислот 2Al + 6HCl = 2AlCl3 +
- 10. Алюмотермия Алюминий при высокой температуре реагирует с оксидами менее активных металлов (Алюминотермия – получение металлов: Fe,
- 11. Амфотерные свойства Так как алюминий – амфотерный металл, он реагирует с растворами щелочей. 2Al + 2NaOH
- 12. Получение Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) и электролизом расплава AlCl3
- 13. Применение Al
- 14. В природе алюминий встречается только в виде соединений и по распространенности в земной коре занимает первое
- 15. Оксид алюминия Al2О3 Очень твердый (корунд, рубин) в кристаллическом состоянии, порошок белого цвета, тугоплавкий - 20500С,
- 17. Скачать презентацию












 Презентация по Химии "Простые вещества-неметаллы" - скачать смотреть
Презентация по Химии "Простые вещества-неметаллы" - скачать смотреть  Своя игра по химии
Своя игра по химии Методы химического анализа. Классификации методов анализа
Методы химического анализа. Классификации методов анализа МИР МЫЛА Выполнили: Ученица 9 «В» кл. Селиванова С. Ученица 9 «В» кл. Кайрова М.
МИР МЫЛА Выполнили: Ученица 9 «В» кл. Селиванова С. Ученица 9 «В» кл. Кайрова М. Диаграммы бинарных систем, образующих твердые растворы
Диаграммы бинарных систем, образующих твердые растворы Средства бытовой химии. Польза и вред. (Бролиш Рита и Матренина Наташа)
Средства бытовой химии. Польза и вред. (Бролиш Рита и Матренина Наташа) Сульфаниламидные препараты. Хинолоны
Сульфаниламидные препараты. Хинолоны Способы выращивания кристаллов (лекция 3)
Способы выращивания кристаллов (лекция 3) Области применения серной, соляной, азотной, и уксусной кислот
Области применения серной, соляной, азотной, и уксусной кислот Проблема содержания нитратов в пищевых продуктах
Проблема содержания нитратов в пищевых продуктах Технология адсорбционной осушки газа
Технология адсорбционной осушки газа Презентация по химии Эпоха теории флогистона Пневматическая химия Развитие аналитической химии
Презентация по химии Эпоха теории флогистона Пневматическая химия Развитие аналитической химии  Роль ферментов в формировании потребительских свойств продовольственных товаров
Роль ферментов в формировании потребительских свойств продовольственных товаров Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Кремний в природе
Кремний в природе СПЛАВЫ МЕТАЛЛОВ
СПЛАВЫ МЕТАЛЛОВ Массообменные процессы
Массообменные процессы Лекция 6. Растворы электролитов
Лекция 6. Растворы электролитов Блеск и сила здоровых волос
Блеск и сила здоровых волос Презентация Изомерия
Презентация Изомерия  Термические превращения алкенов
Термические превращения алкенов Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1
Интернет-семинар (вебинар). Методика подготовки к олимпиадам и интеллектуальным турнирам по химии. Часть 1 Кристаллическая структура и магнитные свойства нестехиометрических кобальтитов RBaCo4O7+x (x=0,0.1,0.2)
Кристаллическая структура и магнитные свойства нестехиометрических кобальтитов RBaCo4O7+x (x=0,0.1,0.2) «Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань  Химический состав яблока
Химический состав яблока Нуклеиновые кислоты: структура и функции
Нуклеиновые кислоты: структура и функции Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций Харчові добавки, Е-числа і їх вплив на організм людини
Харчові добавки, Е-числа і їх вплив на організм людини