Содержание
- 2. Положение в Периодической системе Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер
- 3. Строение атома алюминия Заряд ядра атома алюминия +13 В атоме 3 энергетических уровня Электронная оболочка атома
- 4. AL Элемент III(A) группы таблицы Д.И. Менделеева Элемент с порядковым № 13, его Элемент 3 -его
- 5. Физические свойства мягкий легкий (с малой плотностью – 2,7 г/см3) с высокой тепло- и электропроводностью легкоплавкий
- 6. Датский физик Ганс Эрстед (1777-1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия
- 7. Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и французом Полем Эру
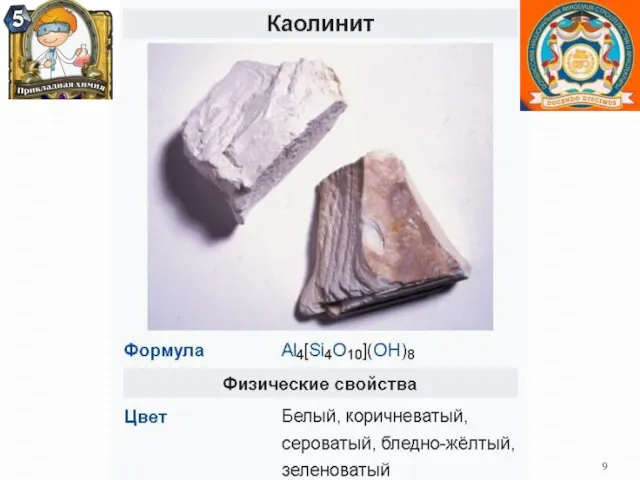
- 8. Нахождение в природе Важнейшим на сегодня минералом алюминия является боксит Основной химический компонент боксита - глинозем
- 17. с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3 с азотом, образуя нитрид алюминия: 2Al
- 18. Химические свойства 1. с водой (после удаления защитной оксидной пленки) 2Al + 6H2O = 2Al(OH)3 +
- 19. Соединения алюминия Оксид алюминия (Al2O3) Гидроксид алюминия Al(OH)3
- 20. Al2O3 Глинозём Корунд сапфир рубин Боксит
- 21. Al2O3 + 6HCl=2AlCl3 + 3H2O Al2O3+ 2NaOH +3H2O=2Na[Al(OH)4]
- 22. Амфотерные свойства Al(OH)3 + 3HCl = AlCl3+ 3H2O Al(OH)3 + NaOH = Nа[Al(OH)4 ] Разлагается при
- 23. ПРИМЕНЕНИЕ АЛЮМИНИЯ
- 25. Скачать презентацию
















![Al2O3 + 6HCl=2AlCl3 + 3H2O Al2O3+ 2NaOH +3H2O=2Na[Al(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/502389/slide-20.jpg)


 Классификация химических реакций
Классификация химических реакций Галогены
Галогены Сложные эфиры в природе и их применение
Сложные эфиры в природе и их применение Презентация для класса Способы получения натрия
Презентация для класса Способы получения натрия  Углеводы. Общие представления об углеводах
Углеводы. Общие представления об углеводах Скандий
Скандий Сульфаты. Лекция 13
Сульфаты. Лекция 13 Презентация по Химии "Аммиак: состав, строение, свойства, применение" - скачать смотреть
Презентация по Химии "Аммиак: состав, строение, свойства, применение" - скачать смотреть  Водород.Способы получения. Физические свойства
Водород.Способы получения. Физические свойства Текстильные волокна
Текстильные волокна  Растворы, классификация растворов
Растворы, классификация растворов Способы определения УЭС пластовой воды
Способы определения УЭС пластовой воды Бионеорганическая химия. Биогенные элементы. (Лекция 5.2)
Бионеорганическая химия. Биогенные элементы. (Лекция 5.2) Металлические сплавы
Металлические сплавы Неон. Получение
Неон. Получение Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Мас-спектр кластерів вуглецю
Мас-спектр кластерів вуглецю Жиры (триглицериды)
Жиры (триглицериды) Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов Горение жидкостей
Горение жидкостей Ph воды
Ph воды Алканы и их свойства
Алканы и их свойства Мышьяк (лат. аrsenicum)
Мышьяк (лат. аrsenicum) «Широко распростирает химия руки свои в дела человеческие! «Широко распростирает химия руки свои в дела человеческие! Куда ни
«Широко распростирает химия руки свои в дела человеческие! «Широко распростирает химия руки свои в дела человеческие! Куда ни Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Живая химия
Живая химия Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий
Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий  Сухой спирт
Сухой спирт