Содержание
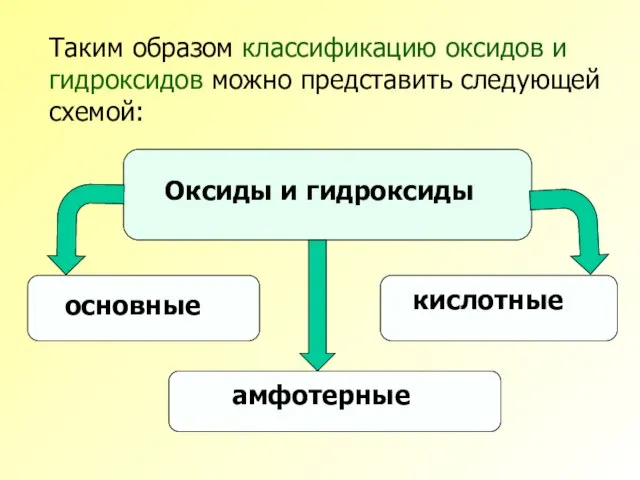
- 2. Все оксиды и гидроксиды по их химическим свойствам можно разделить на три вида: основные амфотерные кислотные
- 3. Если соединение реагирует с кислотой с образованием соли и воды, то оно обладает основными свойствами. Например:
- 4. Если соединение реагирует со щелочью с образованием соли и воды, то оно обладает кислотными свойствами. Например:
- 5. Но есть и вещества - «хамелеоны». При добавлении к таким веществам кислоты, они проявляют основные свойства,
- 6. К амфотерным соединениям относят оксиды и гидроксиды некоторых металлов (в них металл чаще всего имеет степень
- 7. Точно так же и при реакции гидроксида цинка с соляной кислотой образуются соль хлорид цинка и
- 8. Рассмотрим уравнения этих реакций. ZnO+2KOH=K2ZnO2+H2O Zn(OH)2+2KOH=K2ZnO2+2H2O Амфотерный оксид цинка в реакции со щелочью гидроксид калия образовал
- 9. Таким образом классификацию оксидов и гидроксидов можно представить следующей схемой:
- 10. Так как кислотность, основность или амфотерность химических свойств определяют экспериментальным образом, рассмотрим опыт, позволяющий доказать, что
- 11. Внимание! Если для нерастворимого основания не имел значения порядок смешивания растворов, для амфотерного гидроксида он принципиально
- 12. Полученный осадок амфотерного гидроксида алюминия нужно разделить пополам.
- 13. При добавлении к первому образцу гидроксида алюминия избытка кислоты исчезновение осадка доказывает наличие у него основных
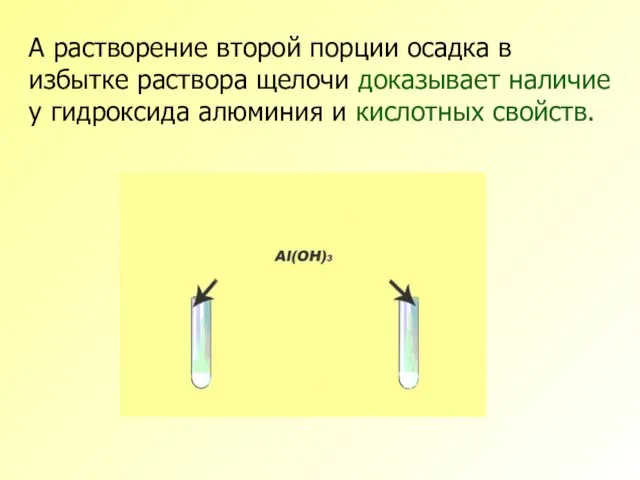
- 14. А растворение второй порции осадка в избытке раствора щелочи доказывает наличие у гидроксида алюминия и кислотных
- 15. Таким образом это исследование доказало кислотно-основную двойственность химических свойств гидроксида алюминия, то есть его амфотерность. Уравнениями
- 16. Реакция гидроксида алюминия с раствором кислоты: Al(OH)3+3HCl=AlCl3+3H2O Реакция гидроксида алюминия с избытком раствора щелочи: Al(OH)3+KOH=K[Al(OH)4] Полученный
- 18. Скачать презентацию













 Химическая связь в кристаллах
Химическая связь в кристаллах Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Ацетилен. Физические и химические свойства
Ацетилен. Физические и химические свойства Великий Ломоносов Работу выполнила учитель химии МБОУ «СОШ №27 с углубленным изучением отдельных предметов» Карташова Л.А.
Великий Ломоносов Работу выполнила учитель химии МБОУ «СОШ №27 с углубленным изучением отдельных предметов» Карташова Л.А. Синтетичні та органічні волокна Виконали: Дорош Таня Мартинко Марина
Синтетичні та органічні волокна Виконали: Дорош Таня Мартинко Марина  Щавелевая кислота
Щавелевая кислота Топливо и топливосжигающие устройства. Горение топлива
Топливо и топливосжигающие устройства. Горение топлива Реакции замещения и реакции обмена
Реакции замещения и реакции обмена Особая роль углерода в наномире
Особая роль углерода в наномире Диаграмма состояния Fe–Fe3C
Диаграмма состояния Fe–Fe3C ОЧКАСОВ ЕВГЕНИЙ МИХАЙЛОВИЧ ПРЕПОДАВАТЕЛЬ ХИМИИ И БИОЛОГИИ ГОСУДАРСТВЕННОГО АВТОНОМНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ СРЕДНЕГО
ОЧКАСОВ ЕВГЕНИЙ МИХАЙЛОВИЧ ПРЕПОДАВАТЕЛЬ ХИМИИ И БИОЛОГИИ ГОСУДАРСТВЕННОГО АВТОНОМНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ СРЕДНЕГО Нефть и способы её переработки
Нефть и способы её переработки Презентация на тему : «Уксусная кислота» Выполнила: ученица 11-Б класса Зануда Т.А Проверила: учитель химии Тисленко Л.А
Презентация на тему : «Уксусная кислота» Выполнила: ученица 11-Б класса Зануда Т.А Проверила: учитель химии Тисленко Л.А  Кислоты, основания, соли в свете ТЭД подготовила: Мартынова Е.Ю._
Кислоты, основания, соли в свете ТЭД подготовила: Мартынова Е.Ю._ Углеводороды
Углеводороды Природні джерела органічних речовин Підготувала Учениця 11-Б класу Білик Вікторія
Природні джерела органічних речовин Підготувала Учениця 11-Б класу Білик Вікторія  Алкандар. (қаныққан көмірсутектер)
Алкандар. (қаныққан көмірсутектер) Фазовые равновесия в двухкомпонентных системах: зависимость растворимости вещества от температуры, криоскопия, эбулиоскопия
Фазовые равновесия в двухкомпонентных системах: зависимость растворимости вещества от температуры, криоскопия, эбулиоскопия Органическая химия. История развития
Органическая химия. История развития каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Методы выращивания кристаллов
Методы выращивания кристаллов Самовосстанавливающиеся материалы
Самовосстанавливающиеся материалы Золь. Свойства золи
Золь. Свойства золи Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Химическая реакция – превращение одних веществ в другие
Химическая реакция – превращение одних веществ в другие Химические знаки и химические формулы Задачи урока: Познакомиться с химическими знаками химических элементов. Рассмотреть стру
Химические знаки и химические формулы Задачи урока: Познакомиться с химическими знаками химических элементов. Рассмотреть стру Химические волокна
Химические волокна Высокомолекулярные соединения (ВМС)
Высокомолекулярные соединения (ВМС)