Содержание
- 2. На уроке мы сможем: Узнать: строение молекулы аммиака и иона аммония; механизм образования связи по донорно-акцепторному
- 3. NH3 Эта история произошла во время I мировой войны.
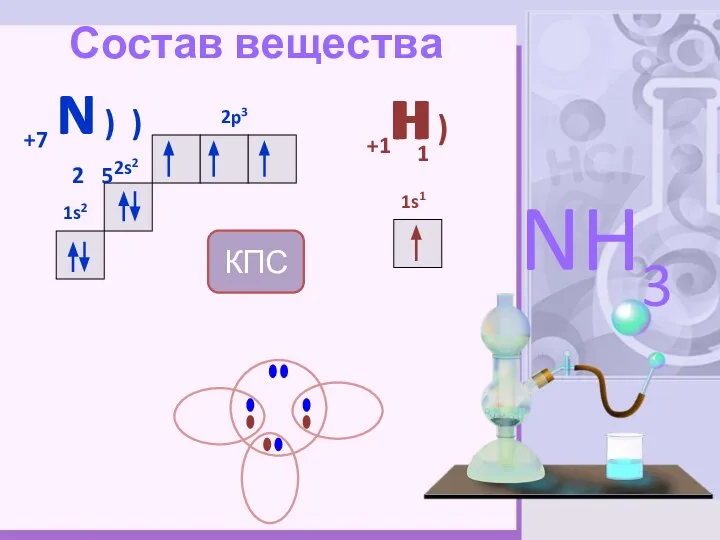
- 4. Состав вещества +7 N ) ) 2 5 2s2 1s2 2p3 +1H ) 1s1 NH3 H
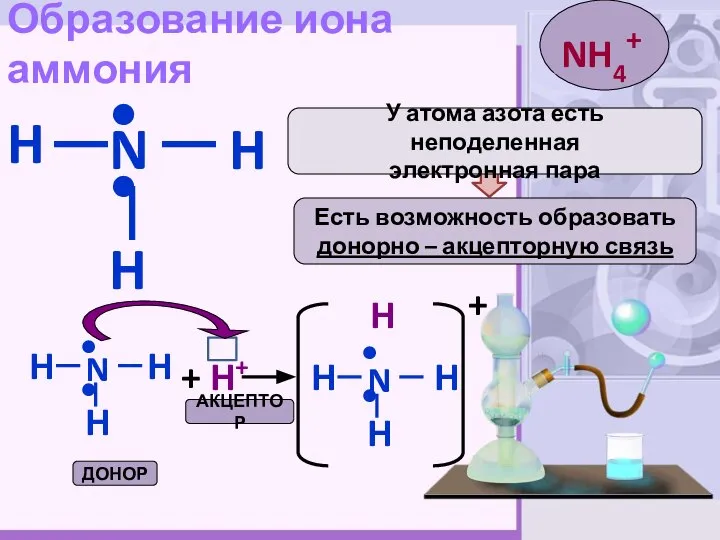
- 5. Образование иона аммония H N H H •• Есть возможность образовать донорно – акцепторную связь У
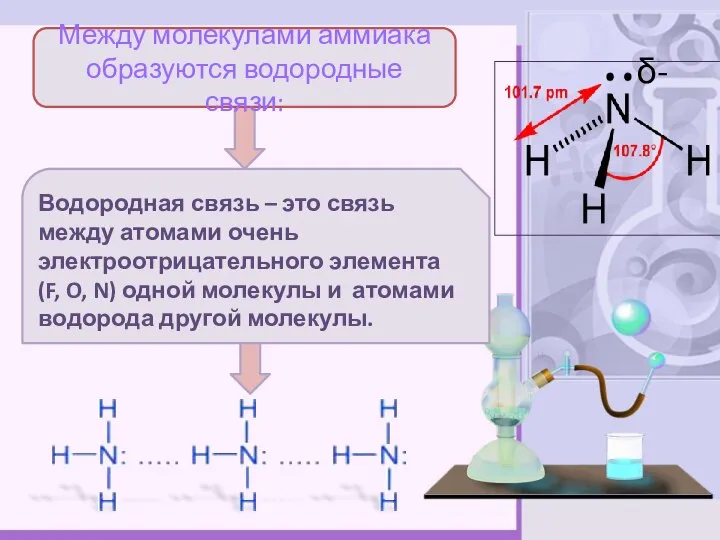
- 6. Между молекулами аммиака образуются водородные связи: Водородная связь – это связь между атомами очень электроотрицательного элемента
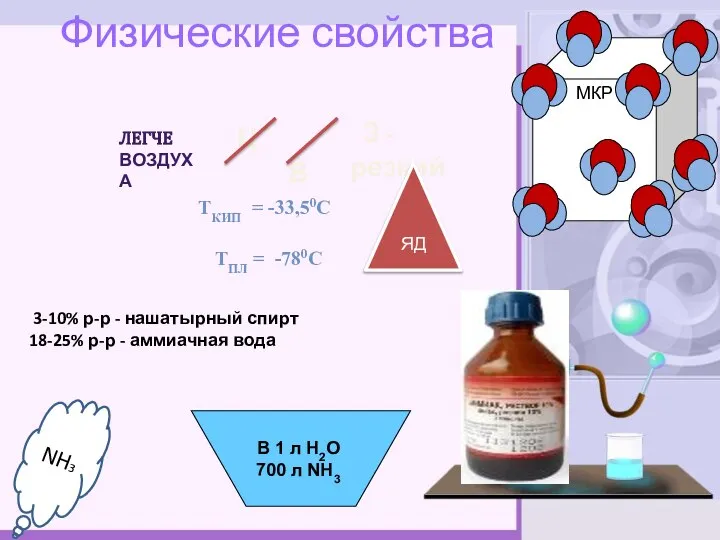
- 7. Ц Физические свойства ТКИП = -33,50С ТПЛ = -780С 3-10% р-р - нашатырный спирт 18-25% р-р
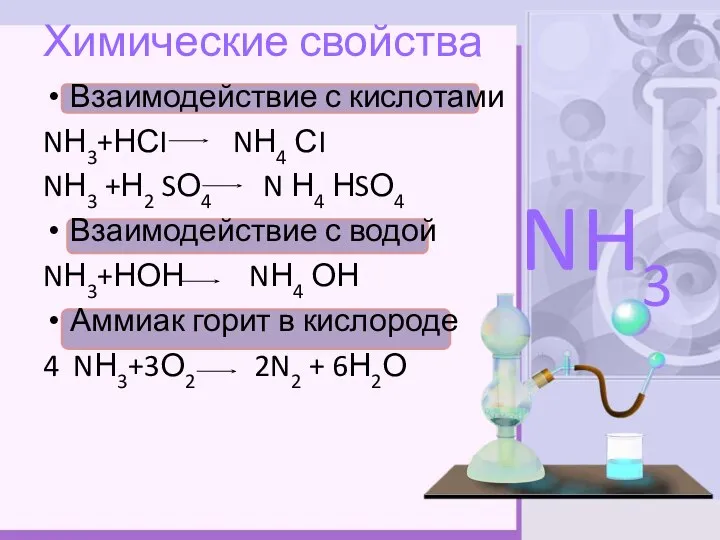
- 8. Химические свойства Взаимодействие с кислотами NН3+НСI NН4 СI NН3 +Н2 SО4 N Н4 НSО4 Взаимодействие с
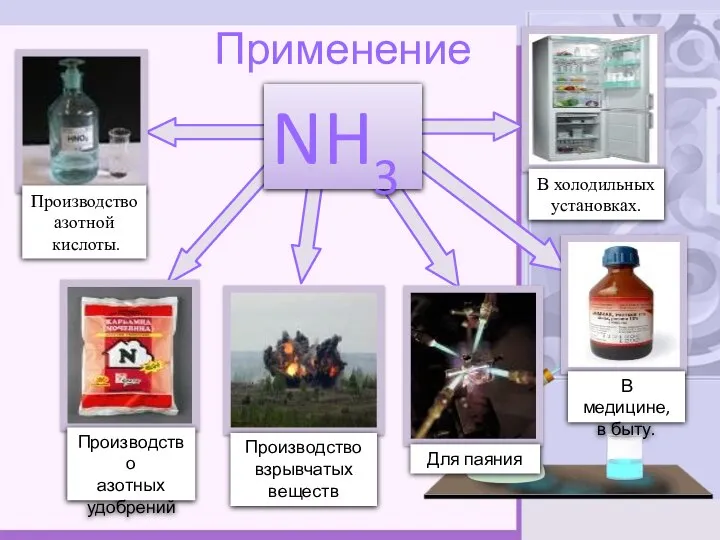
- 9. Применение NH3 Производство азотной кислоты. Производство азотных удобрений Производство взрывчатых веществ В холодильных установках. В медицине,
- 10. Проверка знаний. Решите задачи: При синтезе аммиака промышленным способом, азот объёмом 50 л. (н.у.) прореагировал с
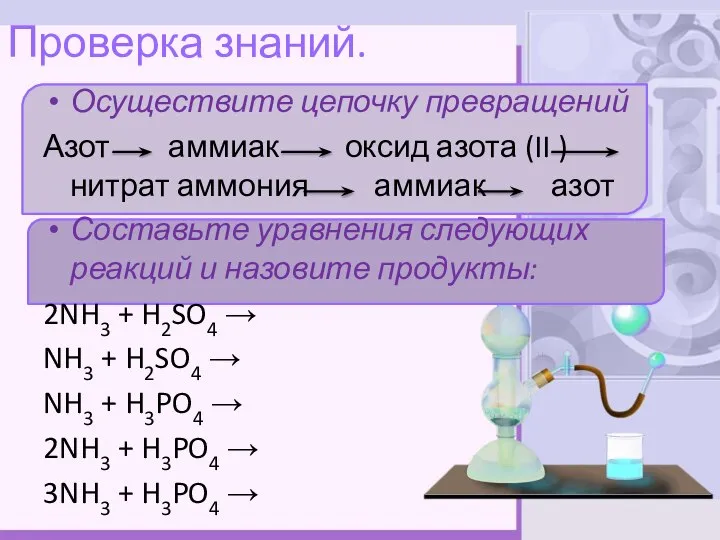
- 11. Проверка знаний. Осуществите цепочку превращений Азот аммиак оксид азота (II ) нитрат аммония аммиак азот Составьте
- 12. Домашнее задание: §25,упр. 1-5. Получение аммиака выучить самостоятельно.
- 14. Скачать презентацию




 Введение. Кристаллография
Введение. Кристаллография Фосфор и его соединения
Фосфор и его соединения Природные и синтетические красители и ароматизаторы
Природные и синтетические красители и ароматизаторы Азот. Химические свойства азота
Азот. Химические свойства азота S,p,d - элементтері
S,p,d - элементтері Поверхностные явления и дисперсные системы
Поверхностные явления и дисперсные системы Презентация по Химии "Менделеев" - скачать смотреть бесплатно
Презентация по Химии "Менделеев" - скачать смотреть бесплатно Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях Градуировка спектральных приборов
Градуировка спектральных приборов Методика решения части С2 ГИА 9 класс
Методика решения части С2 ГИА 9 класс Кремний. Получение кремния. Свойства кремния
Кремний. Получение кремния. Свойства кремния Липиды. Общая характеристика липидов
Липиды. Общая характеристика липидов Витамины молока и молочных продуктов. Жирорастворимые витамины
Витамины молока и молочных продуктов. Жирорастворимые витамины Обобщение сведений об углеводородах
Обобщение сведений об углеводородах Очистка белков (Разделение белков из гетерогенной белковой смеси)
Очистка белков (Разделение белков из гетерогенной белковой смеси) Характеристика переходного металла на основании его положения в Периодической системе. Амфотерность
Характеристика переходного металла на основании его положения в Периодической системе. Амфотерность Методика проведения информированного добровольного тестирования учащихся на наличие наркотических и психотропных веществ
Методика проведения информированного добровольного тестирования учащихся на наличие наркотических и психотропных веществ  Термодинамика силикатов и оксидных соединений. Теплоёмкость и закон Кирхгофа. (Тема 2)
Термодинамика силикатов и оксидных соединений. Теплоёмкость и закон Кирхгофа. (Тема 2) Подгруппа углерода
Подгруппа углерода Строение и свойства белков
Строение и свойства белков Эта удивительная вода Эта удивительная вода
Эта удивительная вода Эта удивительная вода Обмен углеводов, белков, липидов. (Лекция 4)
Обмен углеводов, белков, липидов. (Лекция 4) Фармацевтичний аналіз
Фармацевтичний аналіз Сера. Свойства серы
Сера. Свойства серы «Использование разнообразных форм и средств контроля за качеством образования на уроках химии.»
«Использование разнообразных форм и средств контроля за качеством образования на уроках химии.» Сера и ее соединения
Сера и ее соединения Презентация по Химии "Ярмарок професій" - скачать смотреть
Презентация по Химии "Ярмарок професій" - скачать смотреть  Презентация по Химии "«Закон сохранения массы вещества»" - скачать смотреть
Презентация по Химии "«Закон сохранения массы вещества»" - скачать смотреть