Содержание
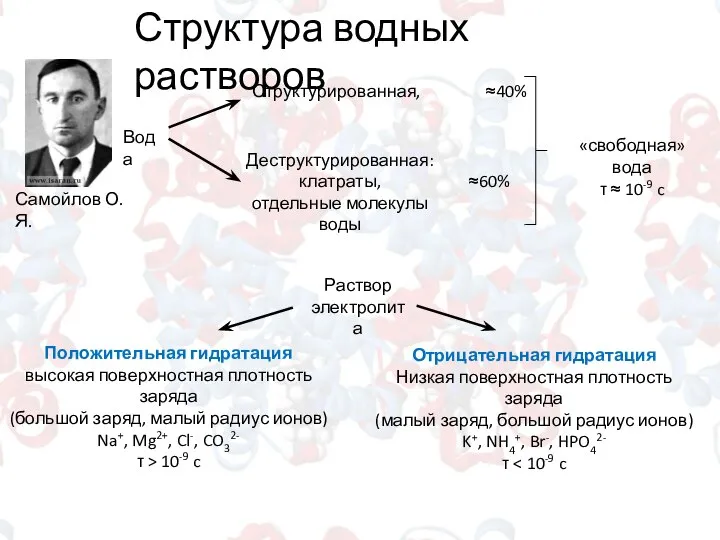
- 2. Структура водных растворов Самойлов О.Я. Вода Структурированная, ≈40% Деструктурированная: клатраты, отдельные молекулы воды ≈60% Раствор электролита
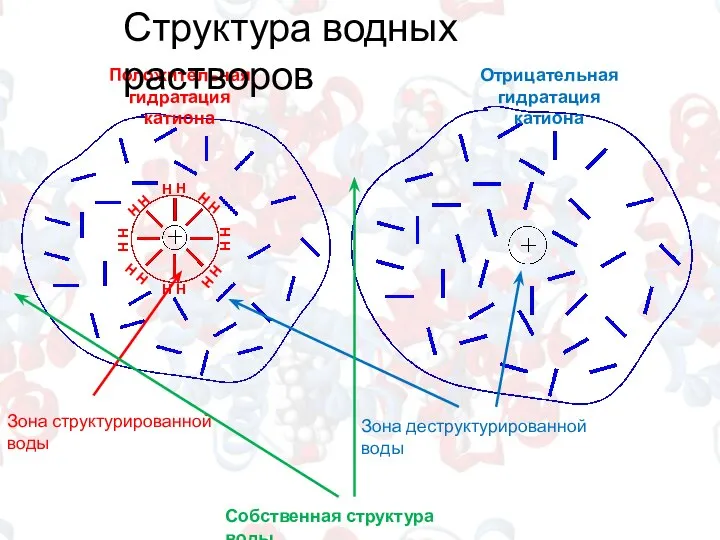
- 3. Положительная гидратация катиона Отрицательная гидратация катиона Зона структурированной воды Зона деструктурированной воды Собственная структура воды Структура
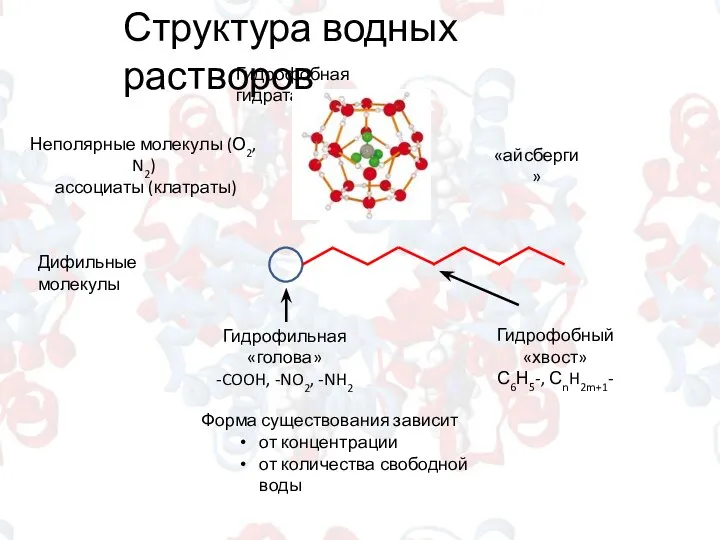
- 4. Структура водных растворов Гидрофобная гидратация Неполярные молекулы (О2, N2) ассоциаты (клатраты) «айсберги» Дифильные молекулы Гидрофильная «голова»
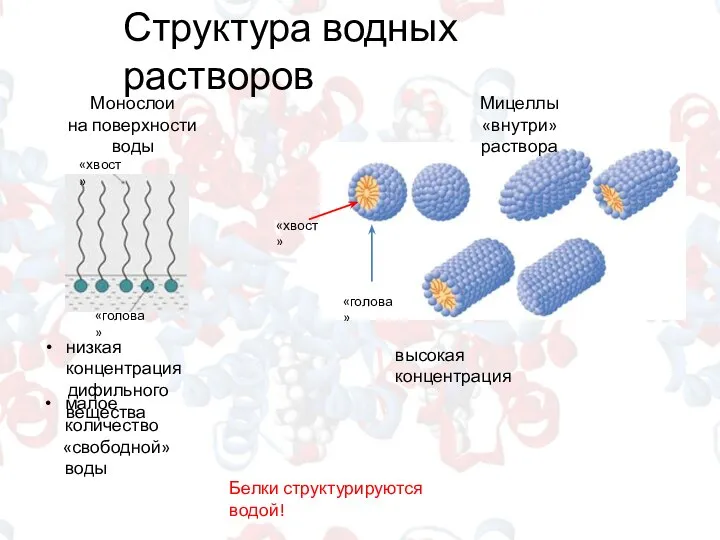
- 5. Структура водных растворов Белки структурируются водой! Монослои на поверхности воды Мицеллы «внутри» раствора низкая концентрация дифильного
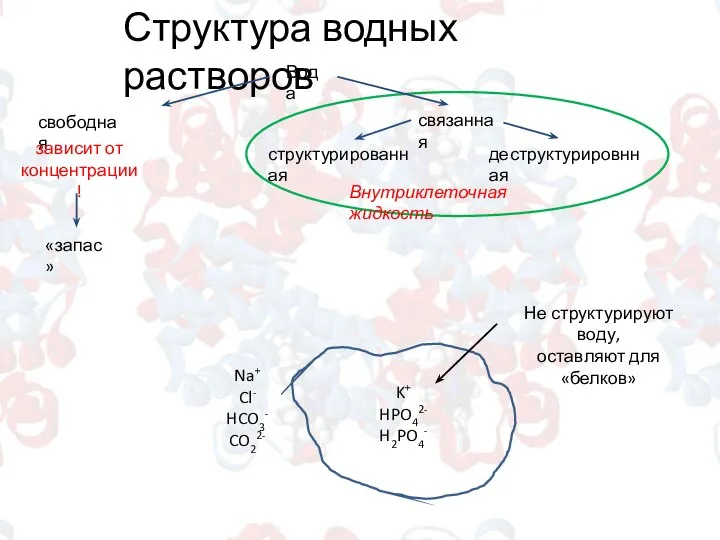
- 6. Структура водных растворов Вода свободная структурированная деструктурировнная связанная Внутриклеточная жидкость «запас» зависит от концентрации! K+ HPO42-
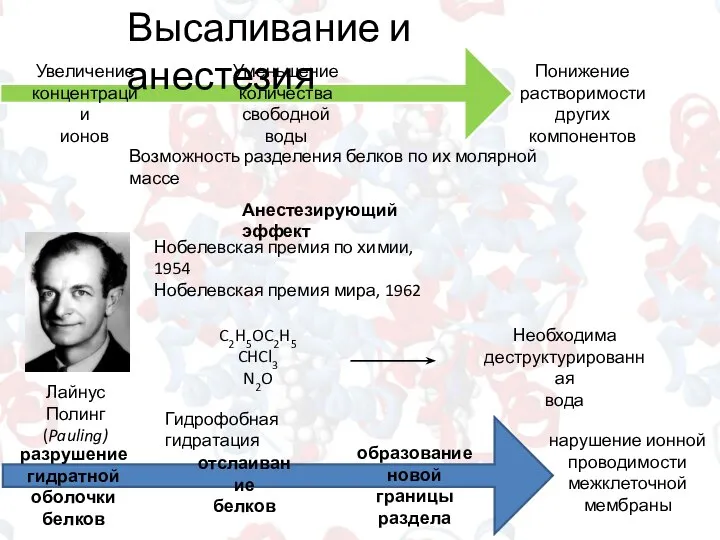
- 7. Высаливание и анестезия Увеличение концентрации ионов Уменьшение количества свободной воды Понижение растворимости других компонентов Возможность разделения
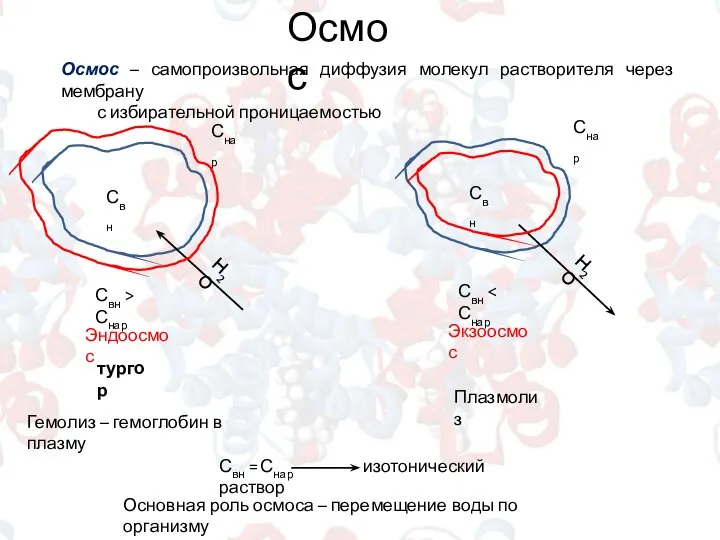
- 8. Осмос Осмос – самопроизвольная диффузия молекул растворителя через мембрану с избирательной проницаемостью Свн Снар Свн >
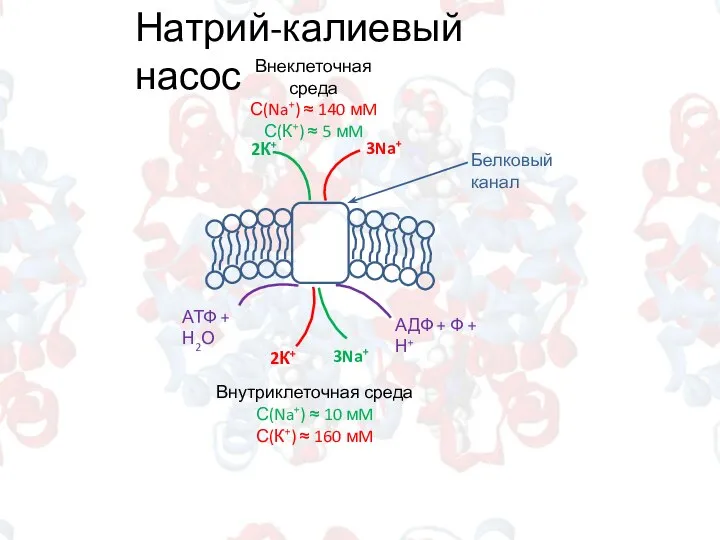
- 9. Натрий-калиевый насос Внеклеточная среда С(Na+) ≈ 140 мM С(К+) ≈ 5 мM Внутриклеточная среда С(Na+) ≈
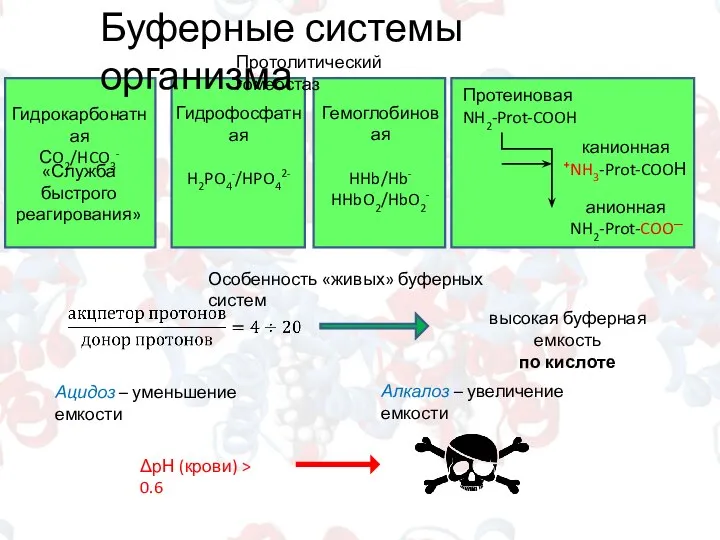
- 10. Буферные системы организма Гидрокарбонатная СO2/HCO3- «Служба быстрого реагирования» Гидрофосфатная H2PO4-/HPO42- Гемоглобиновая HHb/Hb- HHbO2/HbO2- Протолитический гомеостаз Протеиновая
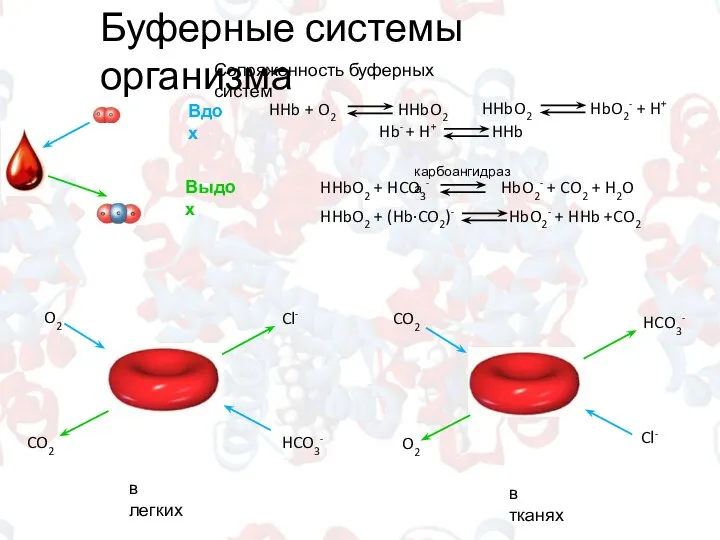
- 11. Буферные системы организма Сопряженность буферных систем карбоангидраза Вдох Выдох O2 HCO3- CO2 Cl- CO2 Cl- O2
- 12. Гетерогенные системы организма Плазма крови [Ca2+] = 1,1∙10-3 M [HPO42-] = 2,9∙10-4 M ИП = 3,2∙10-7
- 14. Скачать презентацию
![Гетерогенные системы организма Плазма крови [Ca2+] = 1,1∙10-3 M [HPO42-] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407212/slide-11.jpg)
 Презентация по Химии "углерод" - скачать смотреть бесплатно
Презентация по Химии "углерод" - скачать смотреть бесплатно Органическая химия. (Урок 1-2)
Органическая химия. (Урок 1-2) Основы безопасности при уничтожении химического оружия
Основы безопасности при уничтожении химического оружия Свойства простых веществ 8 класс
Свойства простых веществ 8 класс Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Основные понятия и законы химии
Основные понятия и законы химии Эмульсии, микроэмульсии и пены. Производство и применение
Эмульсии, микроэмульсии и пены. Производство и применение Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона
Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона Некоторые аспекты физической и коллоидной химии
Некоторые аспекты физической и коллоидной химии Биосинтез липидов
Биосинтез липидов Металлокомплексный катализ. (Лекция 16)
Металлокомплексный катализ. (Лекция 16) Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9 Амедео Авогадро
Амедео Авогадро Физические явления в химии
Физические явления в химии Каучук Органическая химия 10 класс. Школьная коллекция
Каучук Органическая химия 10 класс. Школьная коллекция Скорость химической реакции
Скорость химической реакции Химический турнир
Химический турнир Процессы нитрозирования и основные реакции диазосоединений
Процессы нитрозирования и основные реакции диазосоединений Калитина Тамара Михайловна учитель экологии, биологии МОУ СОШ №3 и учитель химии МОУ СОШ №2 с.Александров-Гай Саратовской обла
Калитина Тамара Михайловна учитель экологии, биологии МОУ СОШ №3 и учитель химии МОУ СОШ №2 с.Александров-Гай Саратовской обла Классификация углеводов. Глюкоза
Классификация углеводов. Глюкоза Синтез наноматериалов на границах раздела жидкость - жидкость и жидкость - воздух. Метод Ленгмюра - Блоджетт
Синтез наноматериалов на границах раздела жидкость - жидкость и жидкость - воздух. Метод Ленгмюра - Блоджетт Колообіг речовин у природі
Колообіг речовин у природі  ОЧКАСОВ ЕВГЕНИЙ МИХАЙЛОВИЧ ПРЕПОДАВАТЕЛЬ ХИМИИ И БИОЛОГИИ ГОСУДАРСТВЕННОГО АВТОНОМНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ СРЕДНЕГО
ОЧКАСОВ ЕВГЕНИЙ МИХАЙЛОВИЧ ПРЕПОДАВАТЕЛЬ ХИМИИ И БИОЛОГИИ ГОСУДАРСТВЕННОГО АВТОНОМНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ СРЕДНЕГО Нефть и способы её переработки
Нефть и способы её переработки Метод окислительно-восстановительного титрования
Метод окислительно-восстановительного титрования Обмен фосфолипидов и стероидов
Обмен фосфолипидов и стероидов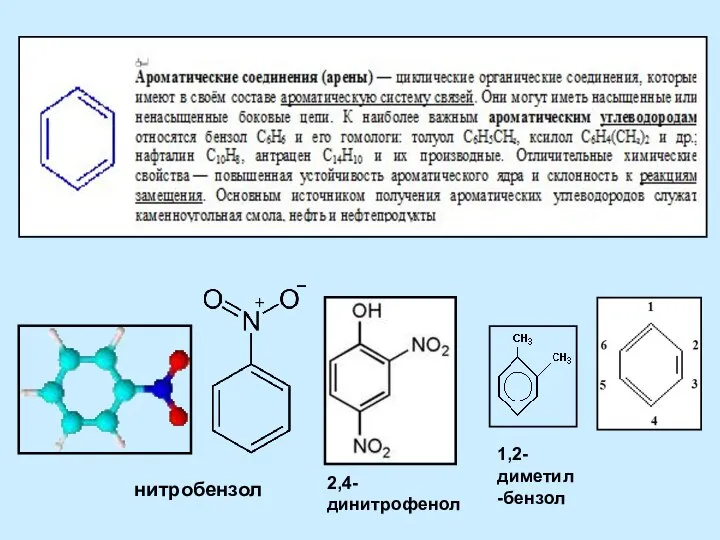 Ароматические соединения (арены)
Ароматические соединения (арены) Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация