Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания о составе, механизме действия, расчете водородного показателя буферных системах. РАЗВИВАЮЩАЯ: расширить
- 3. Arrhenius 1884 г. (ТЭД): кислота - это электролит, диссоциирующий с образованием протона H+; основание – с
- 4. Основные положения теории: Кислота – частица (молекула или ион), отдающая протон в данной реакции, т.е. донор
- 5. Основные положения теории: Кислота – частица (молекула или ион), отдающая протон в данной реакции, т.е. донор
- 6. H+ H+ H+ H+ Протолитическая теория кислот и оснований Кислота – частица (молекула или ион), отдающая
- 7. H+ H+ H+ H+ Протолитическая теория кислот и оснований Кислота – частица (молекула или ион), отдающая
- 8. Физиологически важные кислоты: Угольная кислота (H2CO3) Фосфорная кислота (H3PO4) Пировиноградная кислота (C3H4O3) Молочная кислота (C3H6O3) Эти
- 9. 2. Основание – частица (молекула или ион), присоединяющая протон в данной реакции, т.е. акцептор H+. Протолитическая
- 10. Протолитическая теория кислот и оснований Основание – частица (молекула или ион), присоединяющая протон в данной реакции,
- 11. H+ H+ H+ H+ Протолитическая теория кислот и оснований Основание – частица (молекула или ион), присоединяющая
- 12. Физиологически важные основания: Гидрокарбонат-ион (HCO3- ) Гидрофосфат-ион (HPO4-2 ) Гидрофосфат Гидрокарбонат Протолитическая теория кислот и оснований
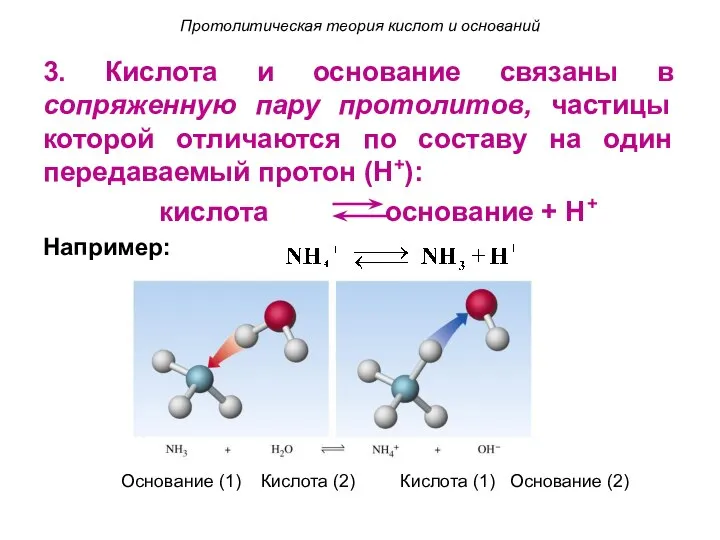
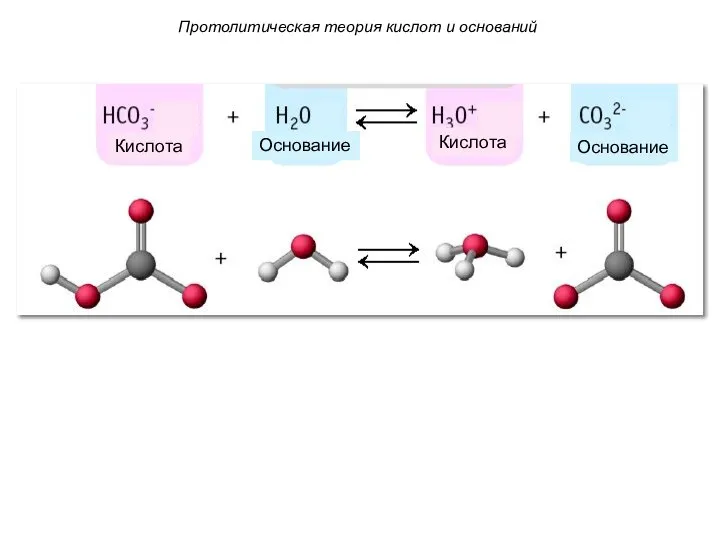
- 13. Протолитическая теория кислот и оснований 3. Кислота и основание связаны в сопряженную пару протолитов, частицы которой
- 14. Кислота Кислота Основание Основание Протолитическая теория кислот и оснований
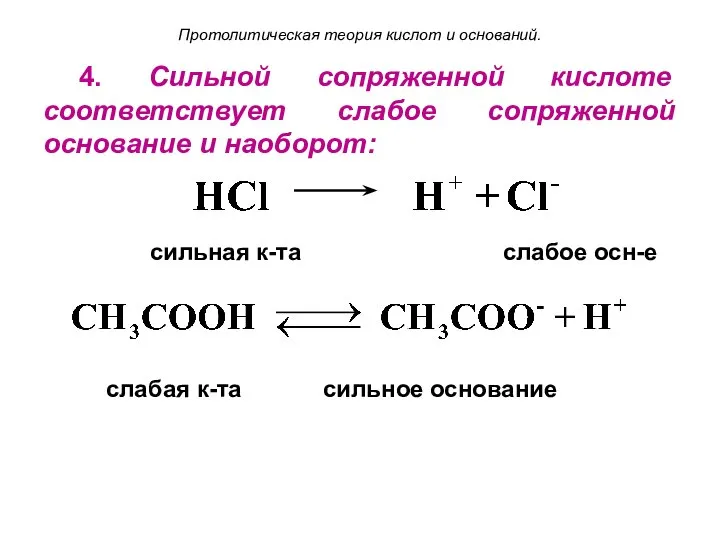
- 15. Протолитическая теория кислот и оснований. 4. Сильной сопряженной кислоте соответствует слабое сопряженной основание и наоборот: сильная
- 16. Протолитическая теория кислот и оснований. 5. Кислоты-протолиты делят на 3 класса: А) нейтральные В) катионные С)
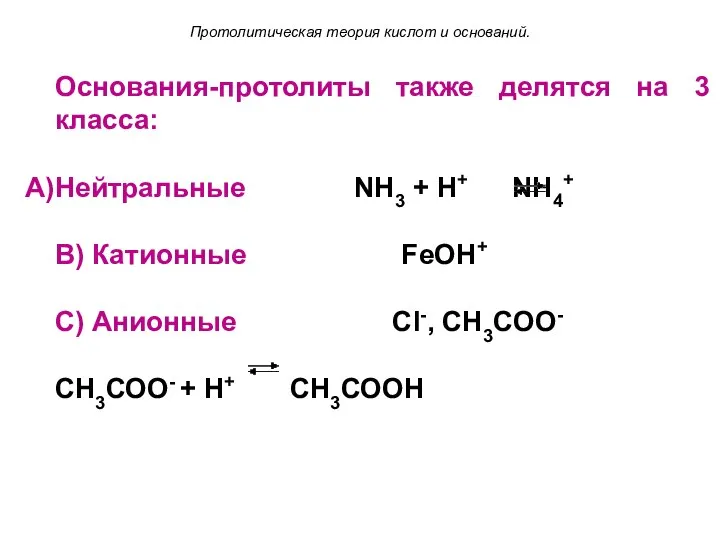
- 17. Основания-протолиты также делятся на 3 класса: Нейтральные NH3 + Н+ NH4+ B) Катионные FeOH+ C) Анионные
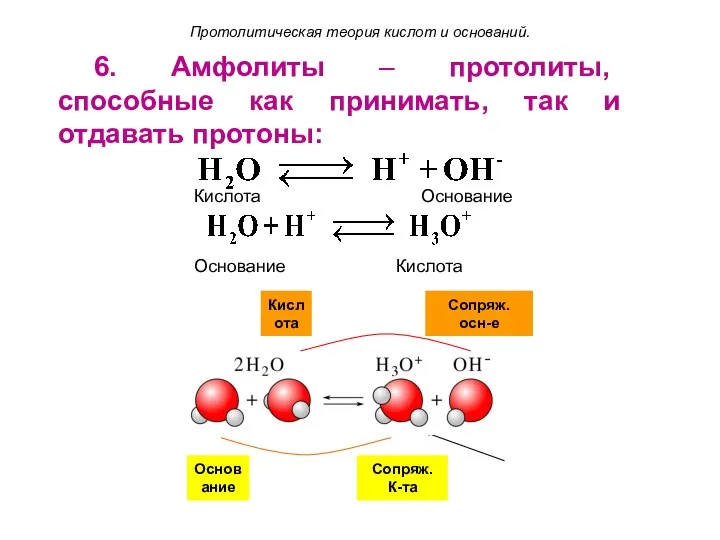
- 18. Кислота Сопряж. осн-е Основание Сопряж. К-та 6. Амфолиты – протолиты, способные как принимать, так и отдавать
- 19. Константа кислотности. 7. Количественно сила кислот-протолитов характеризуется вероятностью переноса протона от кислоты к воде как основанию
- 20. Константа кислотности. Пример:
- 21. Константа кислотности. Перемножим обе части уравнения на постоянную величину молярной концентрации воды: Таким образом, чем выше
- 22. На практике используют показатель константы кислотности (pKa): Чем меньше значение pKa, тем сильнее кислота. Протолитическая теория
- 23. 0.1 M HCl 0.1 M CH3COOH Например: 1) Ka(HCl)=103 pKa(HCl) = -3 (сильная кислота) 2) Ka(CH3COOH)
- 24. Буферными называют системы, состоящие из двух сопряженных компонентов, способных до определенного предела противодействовать изменению рН среды
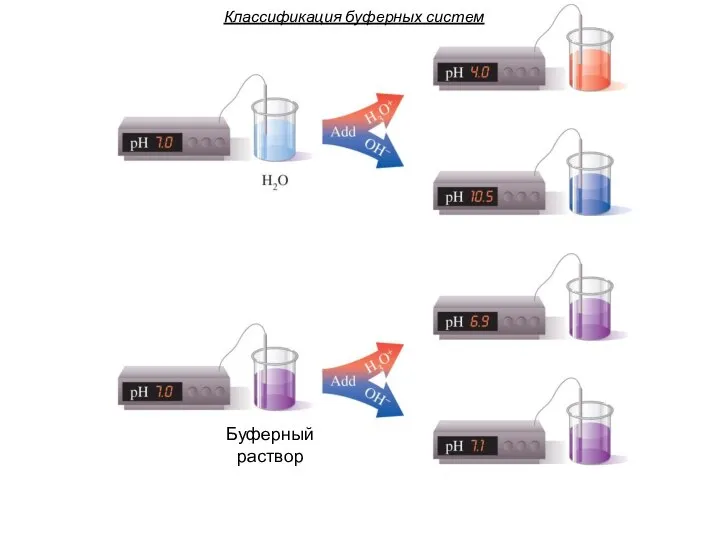
- 25. Классификация буферных систем Буферный раствор
- 26. Классификация буферных систем Способность буферных систем сохранять постоянство pH называется буферным действием. По составу, с точки
- 27. Классификация буферных систем Кислые буферные системы состоят из слабой кислоты и сопряженного с ней избытка сильного
- 28. Классификация буферных систем Карбонатная буферная система: Н2СО3 NaНСО3 Фосфатная буферная система: NaН2РО4 Na2НРО4 Белковая буферная система:
- 29. Классификация буферных систем Основные буферные системы состоят из слабого основания и сопряженного с ним избытка кислоты,
- 30. Классификация буферных систем Буферные системы в растворенном состоянии образуют буферные растворы. Буферные растворы, в отличие от
- 31. Механизм буферного действия Механизм буферного действия можно рассмотреть на примере ацетатной буферной системы: СН3СООН СН3СОО- +
- 32. Механизм буферного действия При добавлении сильной кислоты, например HCl, в реакцию с ней вступает компонент буферной
- 33. Механизм буферного действия При добавлении сильного основания, например NaОН, в реакцию с ним вступает компонент буферной
- 34. Таким образом, постоянство pH поддерживается за счет того, что избыток свободных ионов H+ или OH- связывается
- 35. Водородный показатель среды буферных растворов В основе расчета pH буферных систем лежит закон действующих масс для
- 36. Константа кислотности кислотно-основного равновесия диссоциации уксусной кислоты равна: Отсюда: Водородный показатель среды
- 37. Водородный показатель среды Согласно принципу Ле Шателье-Брауна, присутствие в растворе СН3СООNa создает избыток ацетат-ионов СН3СОО- и
- 38. Уравнение принимает вид: Уравнение в логарифмической форме: Водородный показатель среды
- 39. Водородный показатель среды
- 40. Водородный показатель среды Уравнение Гендерсона-Гассельбаха для основных буферных систем:
- 41. При разбавлении водой меняются концентрации соли и кислоты в одинаковой степени, соотношение же этих концентраций остается
- 42. Водородный показатель среды Рабочие формулы уравнения Гендерсона-Гассельбаха:
- 43. Водородный показатель среды
- 44. Водородный показатель среды Задача 1. Рассчитайте рН ацетатной буферной системы, состоящей из 100 см3 раствора уксусной
- 45. Зона буферного действия Способность буферных растворов противодействовать резкому изменению рН при прибавлении к ним кислоты или
- 46. Зона буферного действия Зона буферного действия – интервал значений pH, в пределах которого буферная система сохраняет
- 47. Величину, характеризующую способность буферной системы противодействовать смещению реакции среды при добавлении кислот и щелочей, называют буферной
- 48. Буферная емкость V(X) – объем кислоты или основания, см3. V1 – объем исходного буферного раствора, см3.
- 49. Если V1 = 1 дм3, ΔрН = 1, тогда Величина буферной емкости зависит от природы и
- 50. Буферные системы крови Биологическая роль буферных систем Буферные системы участвуют в поддержании кислотно-основного гомеостаза. Внутриклеточные и
- 51. Буферные системы крови Кровь содержит шесть буферных систем. Буферные системы крови: Гемоглобиновая: HHb H+ + Hb-
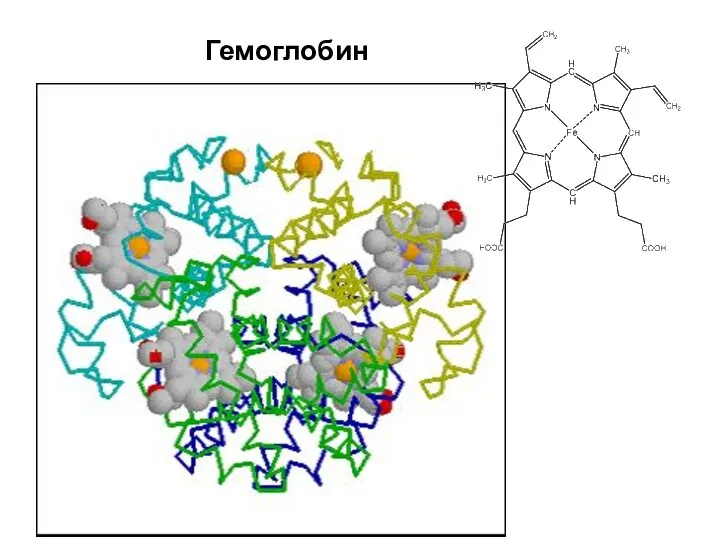
- 52. Гемоглобин
- 53. В сумме эти две системы обладают 75% буферной емкости крови. Они играют важную роль в процессе
- 54. 3. Белковая буферная система: Prot H H+ + Prot- Prot Na Na+ + Prot- Эта система
- 55. В макромолекуле белка многочисленными отрицательные заряды сосредоточены на внешней стороне, и положительные заряды в щелях молекулы.
- 56. H+ ионы притягиваются к отрицательным зарядам. H+ H+ H+ H+ H+ H+ H+ H+ H+ H+
- 57. OH- ионы притягиваются к положительным зарядам. OH- OH- OH- OH- OH- OH- OH- OH- OH- OH-
- 58. OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- H+ H+ H+ H+
- 59. Буферные системы крови 4. Система эфиров глюкозы и фосфорной кислоты O Глюкоза P OH ONa O
- 60. Буферные системы крови 5. Карбонатная буферная система Н2СО3 Н+ + НСО3 – NaHCO3 Na+ +HCO3– Характеризует
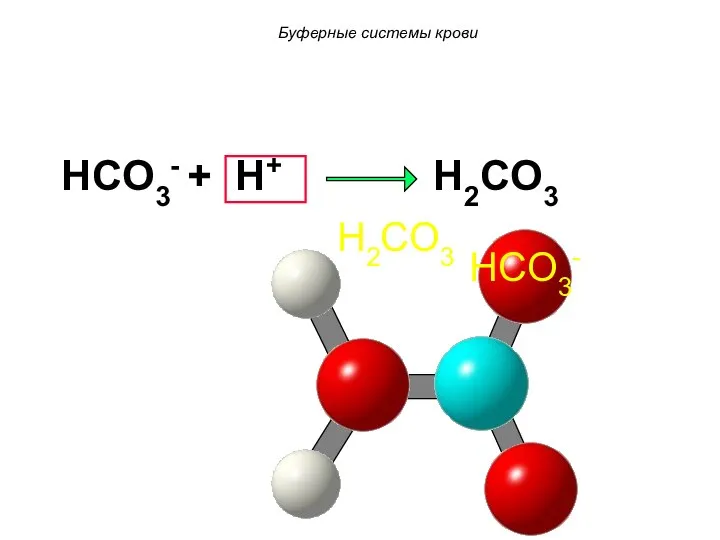
- 61. HCO3- + H+ H2CO3 HCO3- H2CO3 Буферные системы крови
- 62. HCO3- H2CO3 Буферные системы крови
- 63. Кислотно-щелочное (кислотно-основное) состояние организма оценивают с помощью уравнения Гендерсона-Гассельбаха, выведенного для гидрокарбонатного буфера крови. рКа (
- 64. В крови Н2СО3 полностью разлагается на СО2 и Н2О, поэтому [Н2СО3] = [СО2], а [NaHCO3] =
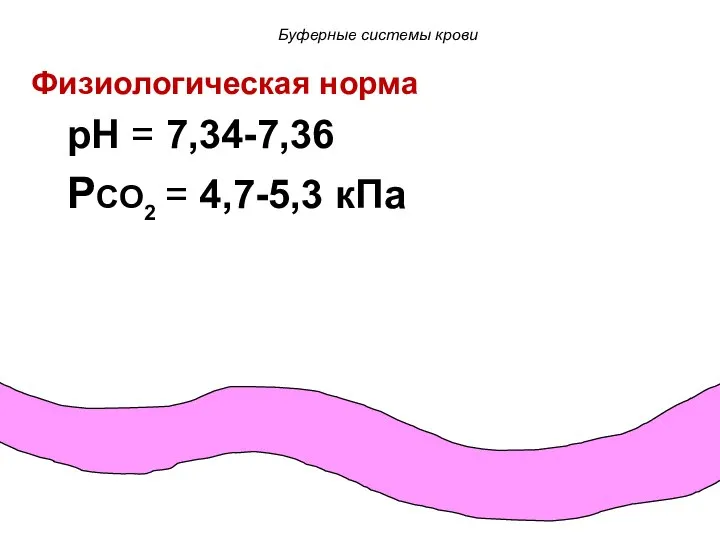
- 65. Физиологическая норма pH = 7,34-7,36 PCO2 = 4,7-5,3 кПа Буферные системы крови
- 66. При задержке СО2 в крови, буферное отношение станет: , т.е. кислотно-щелочное равновесие смещается в сторону повышения
- 67. Ацидоз H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+
- 68. Если из организма очень быстро выводится СО2, то В этом случае кислотно-основное равновесие смещается в сторону
- 69. H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+
- 70. OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH-
- 71. Таким образом, кислотно-щелочное состояние крови определяется величиной pH, концентрацией ионов HCO3- и давлением СО2 в крови.
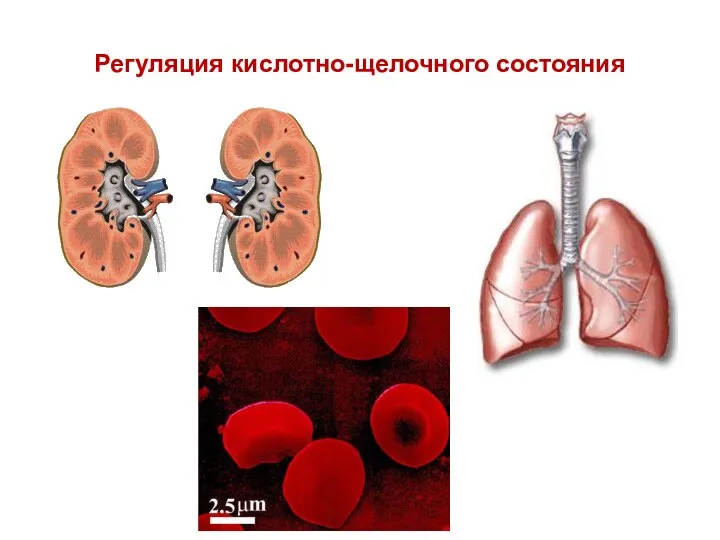
- 72. Регуляция кислотно-щелочного состояния
- 73. Поскольку в регуляции кислотно-щелочного состояния крови принимают участие легкие и почки, то различают метаболический и респираторный
- 74. Буферные системы крови
- 75. CO2 + H2O H2CO3 H+ + HCO3- Респираторный ацидоз Респираторный алкалоз Буферные системы крови
- 76. H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+ H+
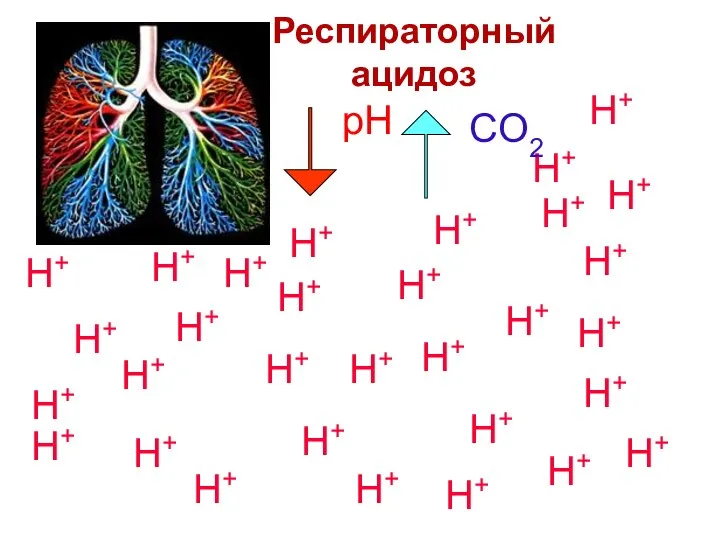
- 77. Респираторный ацидоз Гиповентиляция легких Характеризуется уменьшением pH и увеличением CO2 CO2 CO2 CO2 CO2 CO2 CO2
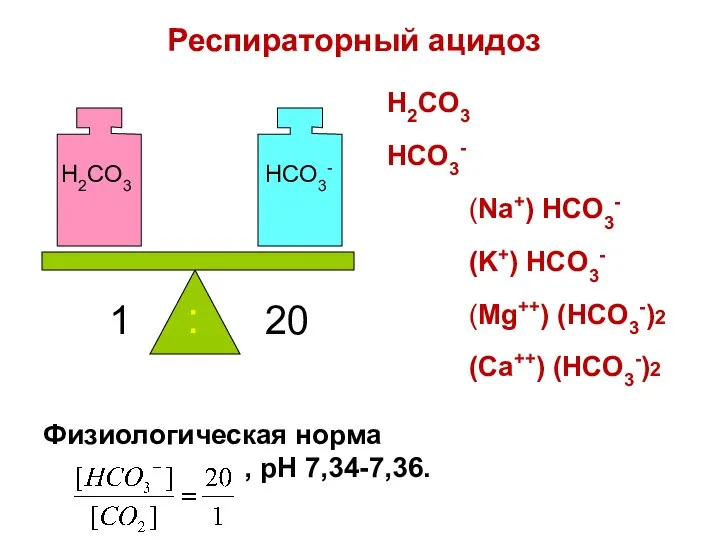
- 78. H2CO3 HCO3- 1 20 : H2CO3 HCO3- (Na+) HCO3- (K+) HCO3- (Mg++) (HCO3-)2 (Ca++) (HCO3-)2 Респираторный
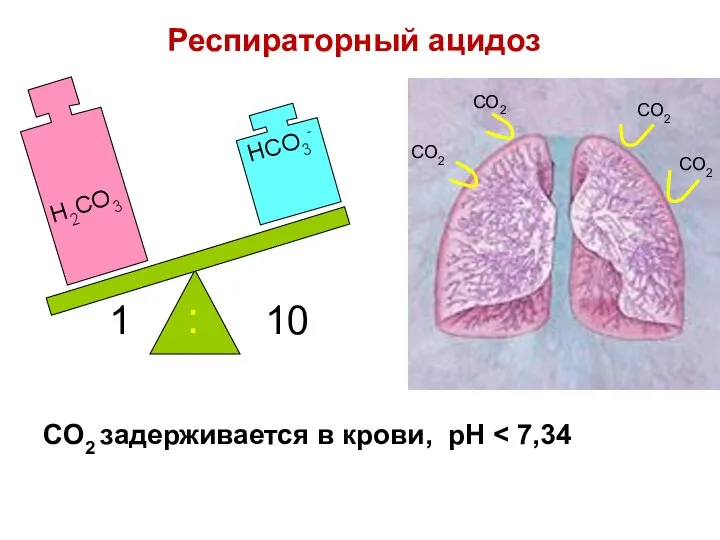
- 79. CO2 задерживается в крови, pH H2CO3 HCO3- 1 10 : CO2 CO2 CO2 CO2 Респираторный ацидоз
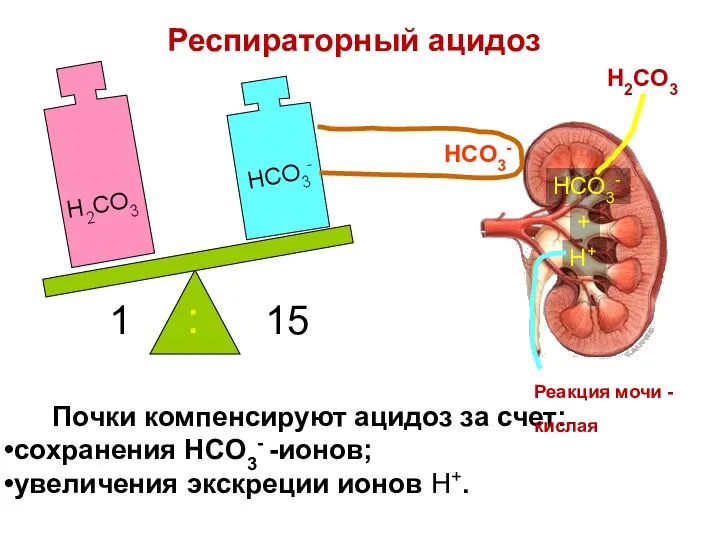
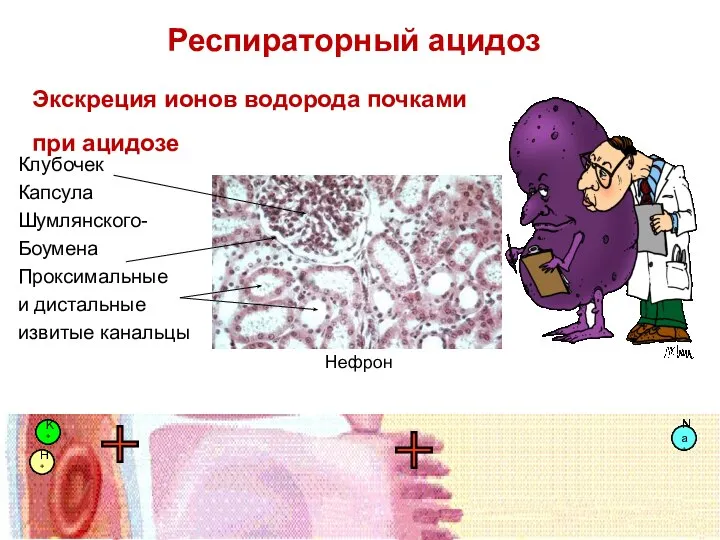
- 80. Почки компенсируют ацидоз за счет: сохранения HCO3- -ионов; увеличения экскреции ионов H+. H2CO3 HCO3- 1 15
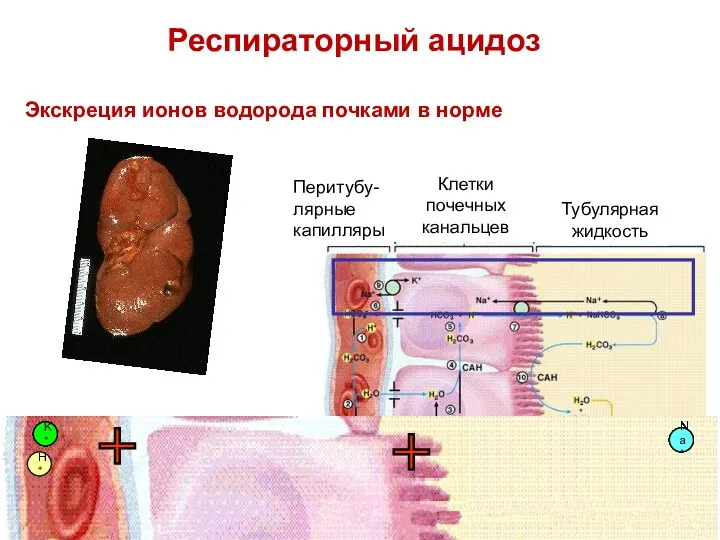
- 81. Экскреция ионов водорода почками в норме K+ K+ K+ K+ K+ K+ K+ Na+ Na+ Na+
- 82. K+ K+ K+ Na+ Na+ Na+ Na+ Na+ Na+ H+ H+ H+ H+ H+ H+ H+
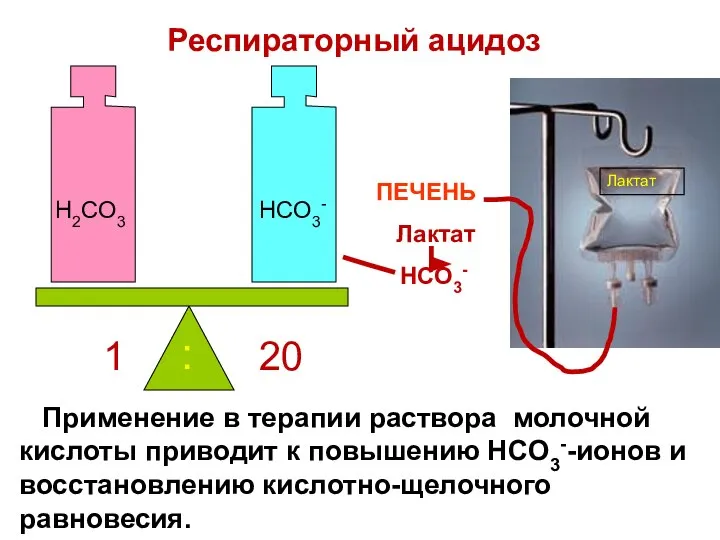
- 83. Применение в терапии раствора молочной кислоты приводит к повышению HCO3--ионов и восстановлению кислотно-щелочного равновесия. H2CO3 HCO3-
- 84. Респираторный алкалоз OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH- OH-
- 85. Гипервентиляция легких. Характеризуется увеличением pH и снижением CO2. CO2 CO2 CO2 CO2 CO2 CO2 CO2 CO2
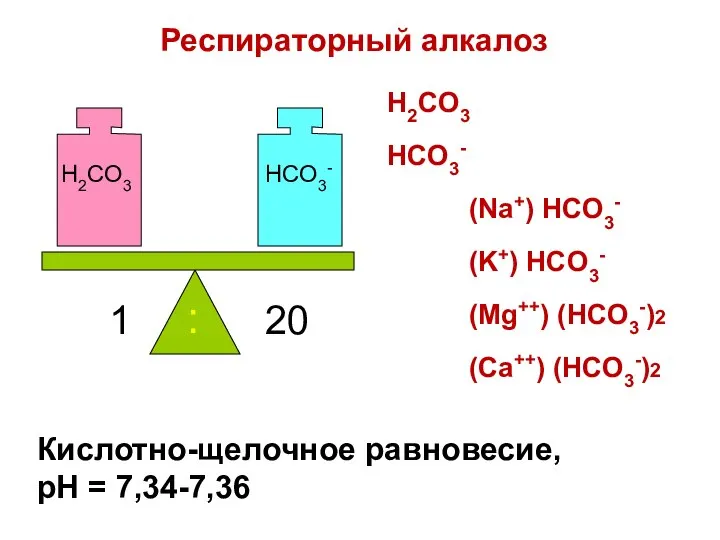
- 86. Кислотно-щелочное равновесие, pH = 7,34-7,36 H2CO3 HCO3- 1 20 : H2CO3 HCO3- (Na+) HCO3- (K+) HCO3-
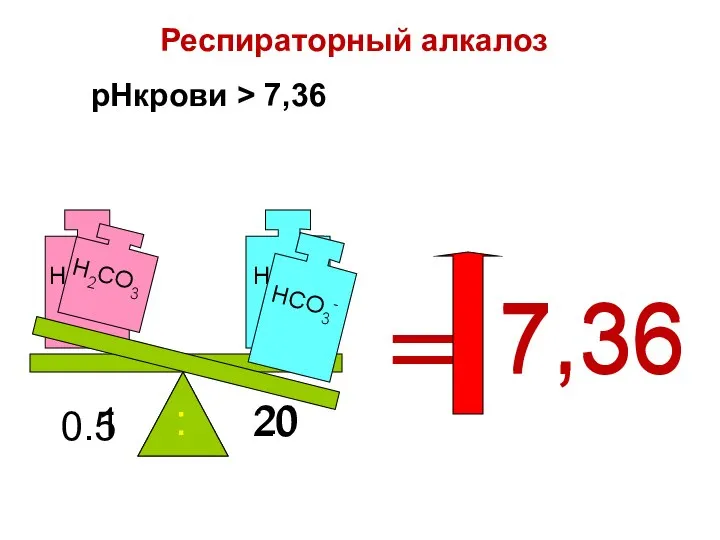
- 87. pHкрови > 7,36 = 7.36 0.5 20 : = 7,36 Респираторный алкалоз
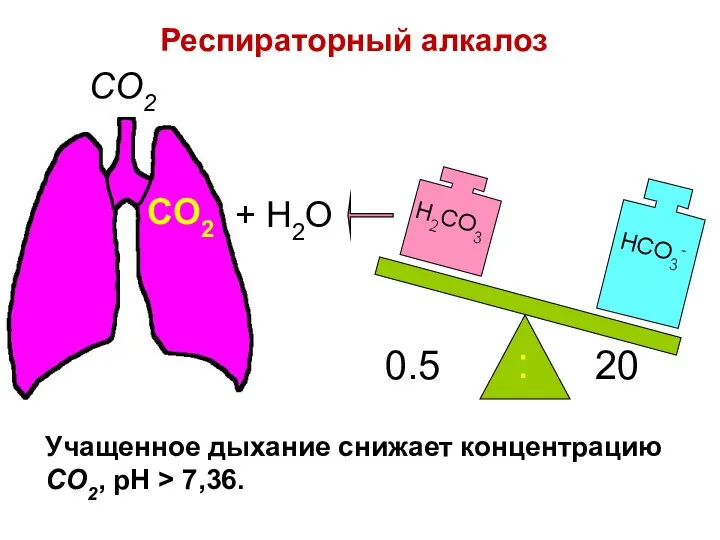
- 88. H2CO3 0.5 20 : CO2 CO2 + H2O Респираторный алкалоз Учащенное дыхание снижает концентрацию CO2, pH
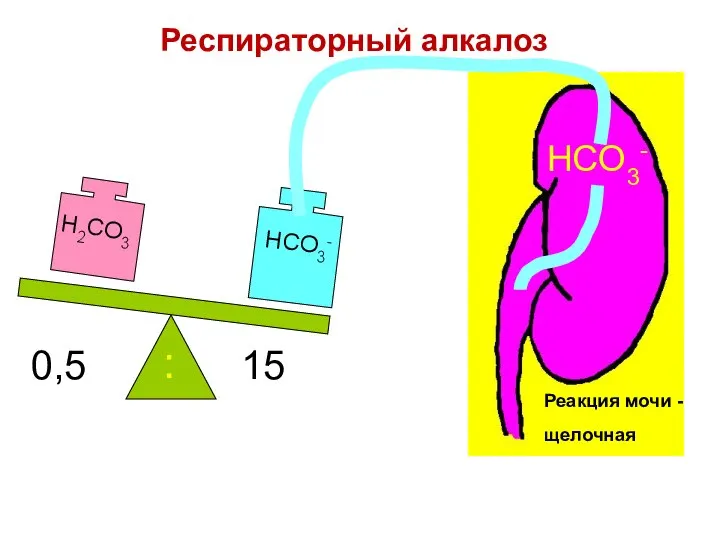
- 89. 0,5 15 : HCO3- Реакция мочи - щелочная Респираторный алкалоз
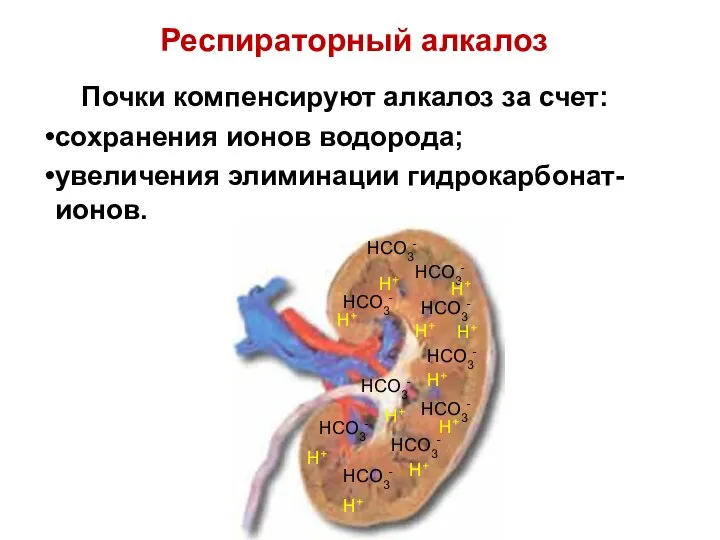
- 90. Почки компенсируют алкалоз за счет: сохранения ионов водорода; увеличения элиминации гидрокарбонат-ионов. H+ HCO3- HCO3- HCO3- HCO3-
- 91. HCO3- -ионы замещают ионами Cl- . H2CO3 HCO3- 0,5 10 : Cl- Раствор с ионами Cl-
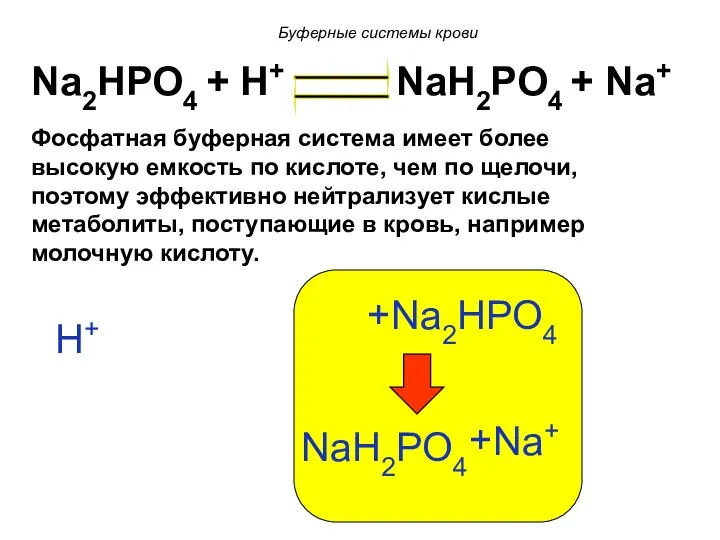
- 92. 6) Фосфатная буферная система КH2PO4 ↔ К+ + H2PO4 - - слабая кислота Na2HPO4 ↔ 2Na+
- 93. Na2HPO4 + H+ NaH2PO4 + Na+ Присутствует вне и внутри клетки, где ее роль более выражена.
- 94. Na2HPO4 + H+ NaH2PO4 + Na+ H+ Na2HPO4 + NaH2PO4 Na+ + Фосфатная буферная система имеет
- 95. HPO4-2 Фосфатная буферная система имеет наибольшее значение в таких биологических жидкостях, как моча, соки пищеварительных желез,
- 97. Скачать презентацию














































![В крови Н2СО3 полностью разлагается на СО2 и Н2О, поэтому [Н2СО3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405659/slide-63.jpg)













 Total Syntheses of Trichorabdal A and Maoecrystal Z
Total Syntheses of Trichorabdal A and Maoecrystal Z Презентация по Химии "Соединения кальция." - скачать смотреть бесплатно_
Презентация по Химии "Соединения кальция." - скачать смотреть бесплатно_ Ph воды
Ph воды Изомерия в органической химии
Изомерия в органической химии Волокна
Волокна  Лекция 7. Электрохимические процессы
Лекция 7. Электрохимические процессы Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Мухит пен өзен суларының қаттылық қасиеттерін анықтау
Мухит пен өзен суларының қаттылық қасиеттерін анықтау Единый государственный экзамен Химия 2021
Единый государственный экзамен Химия 2021 Как «архангельский мужик … стал разумен и велик». О Михаиле Васильевиче Ломоносове
Как «архангельский мужик … стал разумен и велик». О Михаиле Васильевиче Ломоносове  Метан и его свойства.
Метан и его свойства. Презентация по химии Витамины Урок в 10 классе
Презентация по химии Витамины Урок в 10 классе  Витамины в нашей еде
Витамины в нашей еде Одноатомные спирты. Химические свойства
Одноатомные спирты. Химические свойства Игра «Умники и умницы» Горячун Елена Сергеевна учитель химии МБОУ СОШ № 1 г. Сковородино
Игра «Умники и умницы» Горячун Елена Сергеевна учитель химии МБОУ СОШ № 1 г. Сковородино Вплив фосфатної побутової хімії на організм людини.
Вплив фосфатної побутової хімії на організм людини.  Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Конденсированные гетероциклические соединения. Пурины
Конденсированные гетероциклические соединения. Пурины Органикалық қосылыстардың жіктелуі
Органикалық қосылыстардың жіктелуі Лимонная кислота
Лимонная кислота Композитные материалы
Композитные материалы Проблема содержания нитратов в пищевых продуктах
Проблема содержания нитратов в пищевых продуктах Термическая обработка. Превращения при непрерывном охлаждении аустенита. Превращения при отпуск
Термическая обработка. Превращения при непрерывном охлаждении аустенита. Превращения при отпуск Сахара и липиды
Сахара и липиды Жири (тригліцериди)
Жири (тригліцериди) Масла автомобильные
Масла автомобильные Карбонильные соединения
Карбонильные соединения