Содержание
- 2. Диеновые углеводороды (алкадиены) - ациклические углеводороды, содержащие в молекуле две двойные связи между атомами углерода. 2
- 3. Классификация алкадиенов Алкадиены с кумулированными (примыкающими) связями: Алкадиены с изолированными связями: Алкадиены с сопряженными связями: СН2
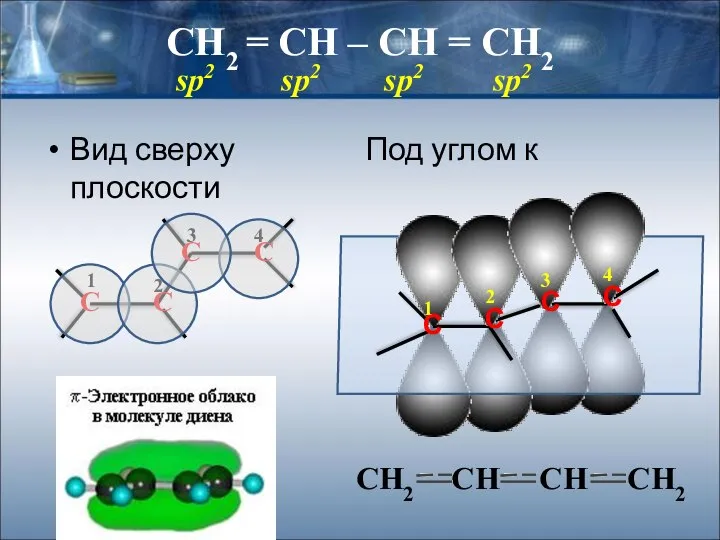
- 4. СН2 = СН – СН = СН2 Вид сверху Под углом к плоскости sp2 sp2 sp2
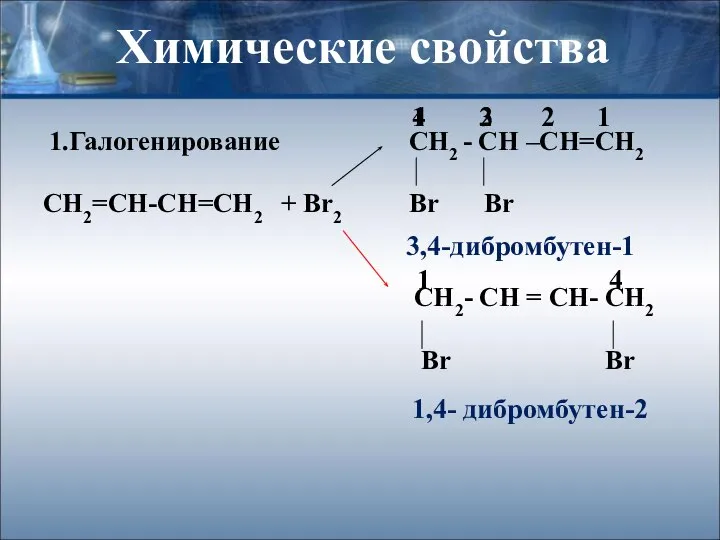
- 5. Химические свойства 1.Галогенирование СН2 - СН –СН=СН2 СН2=СН-СН=СН2 + Br2 Br Br CH2- CH = CH-
- 6. Химические свойства СН2=СН-СН=СН2 + Br2 → СН2 СН СН СН2 + - СН2=СН-СН=СН2 + 2Br2 →
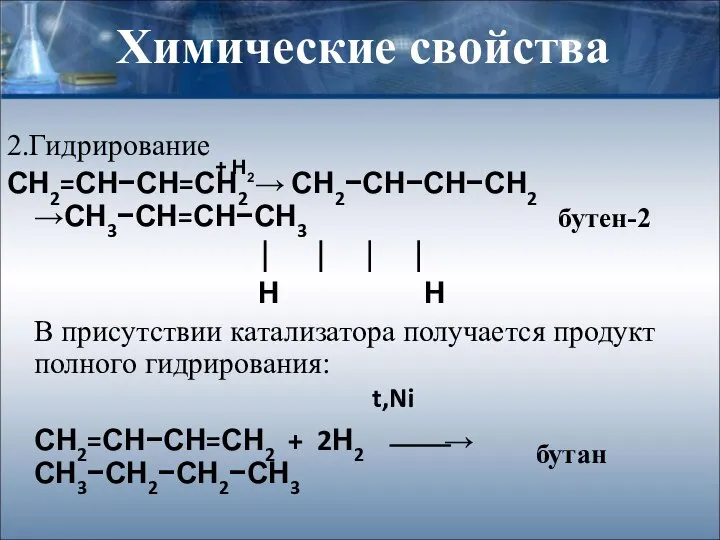
- 7. Химические свойства 2.Гидрирование СН2=СН−СН=СН2 → СН2−СН−СН−СН2 →СН3−СН=СН−СН3 ⏐ ⏐ ⏐ ⏐ Н Н В присутствии катализатора
- 8. Химические свойства 3. Гидрогалогенирование СН2=СН-СН=СН2+HBr → CH3-CH=CH-CH2 Br 1-бромбутен-2
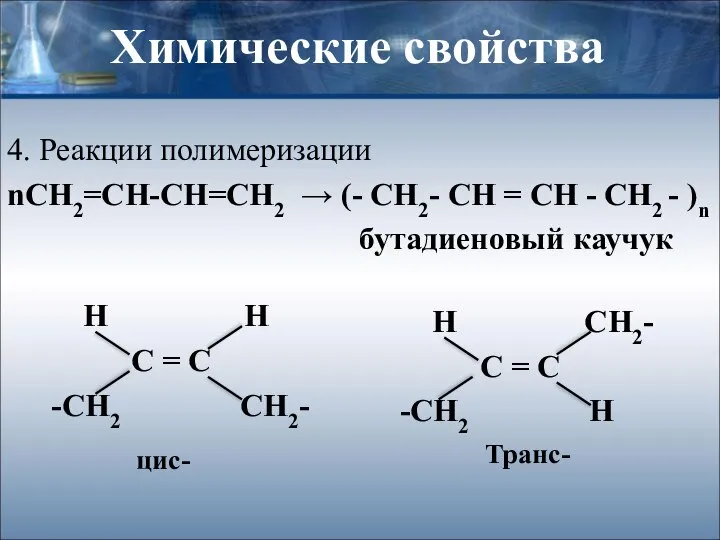
- 9. Химические свойства 4. Реакции полимеризации nСН2=СН-СН=СН2 → (- CH2- CH = CH - CH2 - )n
- 10. Химические свойства 5. Алкадиены горят 2С4 Н6 + 11О2 → 8СО2 + 6Н2О + Q
- 11. Способы получения Метод Лебедева – из этанола при одновременной дегидратации и дегидрировании 2С2Н5ОН → СН2=СН-СН=СН2+Н2 +2Н2О
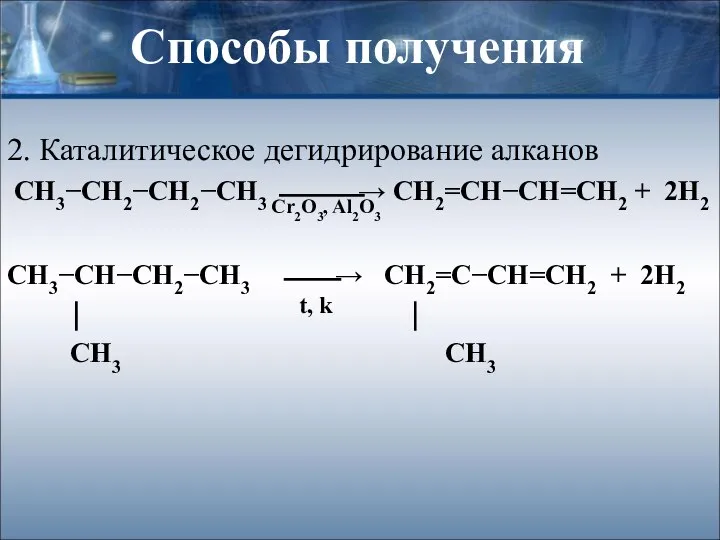
- 12. Способы получения 2. Каталитическое дегидрирование алканов СН3−СН2−СН2−СН3 ⎯⎯⎯→ СН2=СН−СН=СН2 + 2Н2 СН3−СН−СН2−СН3 ⎯⎯→ СН2=С−СН=СН2 + 2Н2
- 13. Способы получения Действие спиртового раствора щелочи на дигалогеналканы: СН2−СН−СН−СН2 + СН2=СН−СН=СН2 + 2KCl + 2Н2О Cl
- 15. Скачать презентацию







 Ферменты. Часть I
Ферменты. Часть I Окислительно-восстановительный процесс - электролиз
Окислительно-восстановительный процесс - электролиз Реактопласти підготував учень 11-в класу Котенко Роман
Реактопласти підготував учень 11-в класу Котенко Роман  Углеводороды Выполнили Филаткина Ирина, Филаткина Марина ученица 11 класса МОБУ СОШ № 7 ЛГО
Углеводороды Выполнили Филаткина Ирина, Филаткина Марина ученица 11 класса МОБУ СОШ № 7 ЛГО  Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция ГИА. Вопрос А2. ПЗ и ПСХЭ
ГИА. Вопрос А2. ПЗ и ПСХЭ Дослідження достовірності реклами з погляду хімії
Дослідження достовірності реклами з погляду хімії Презентация Соли угольной кислоты
Презентация Соли угольной кислоты Лужні метали Властивості, будова, застосування.
Лужні метали Властивості, будова, застосування.  Кислоты. Классификация. Способы получения
Кислоты. Классификация. Способы получения Презентация по Химии "ХІМІЯ" - скачать смотреть бесплатно_
Презентация по Химии "ХІМІЯ" - скачать смотреть бесплатно_ Химия переходных элементов
Химия переходных элементов Коррозия металлов
Коррозия металлов Основные понятия и законы химии
Основные понятия и законы химии Використання кислот
Використання кислот Химия для путешествий во времени
Химия для путешествий во времени Химиялық өнеркәсіп
Химиялық өнеркәсіп Ионообменная хроматография
Ионообменная хроматография Химический элемент платина
Химический элемент платина Дисахариди. Амінокислоти. Пептиди
Дисахариди. Амінокислоти. Пептиди Масс-спектрометрия (МС)
Масс-спектрометрия (МС) Степень окисления
Степень окисления Основные понятия органической химии
Основные понятия органической химии Пятичленные гетероциклические соединения
Пятичленные гетероциклические соединения Правила безпечного використання засобів побутової хімії Підготував ліцеїст групи Е-2 Ліщук Назарій
Правила безпечного використання засобів побутової хімії Підготував ліцеїст групи Е-2 Ліщук Назарій  Электрохимические методы анализа
Электрохимические методы анализа Соединения алюминия
Соединения алюминия Химический брейн-ринг
Химический брейн-ринг