Содержание
- 2. Поверхностные явления А - молекула в объеме Б - молекула на поверхности В –молекула на гребне
- 3. Поверхностные явления На поверхностный слой молекул действует сила, направленная вглубь объема. Она называется поверхностным натяжением (
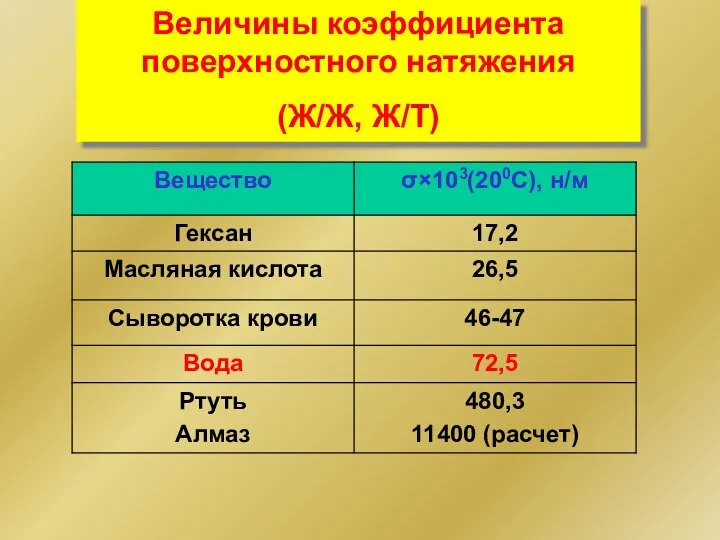
- 4. Величины коэффициента поверхностного натяжения (Ж/Ж, Ж/Т)
- 5. СПЭ в биологии и медицине Полная альвеолярная поверхность легких при вдохе равна 70—80 м2, что примерно
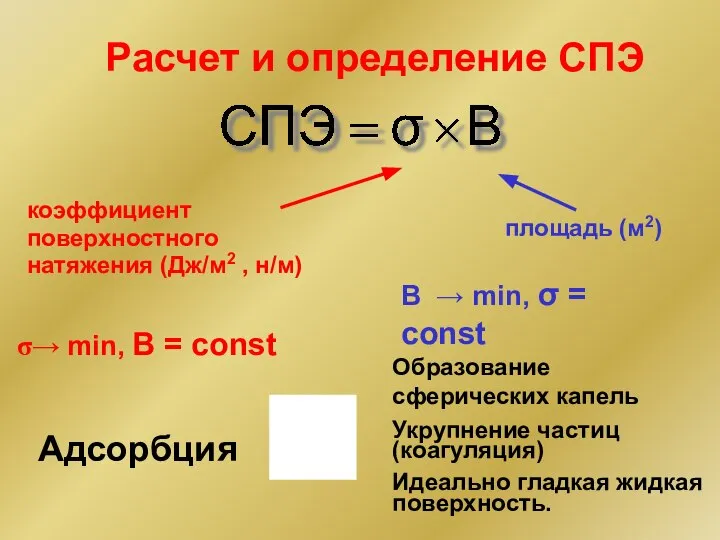
- 6. Расчет и определение СПЭ площадь (м2) коэффициент поверхностного натяжения (Дж/м2 , н/м) B → min, σ
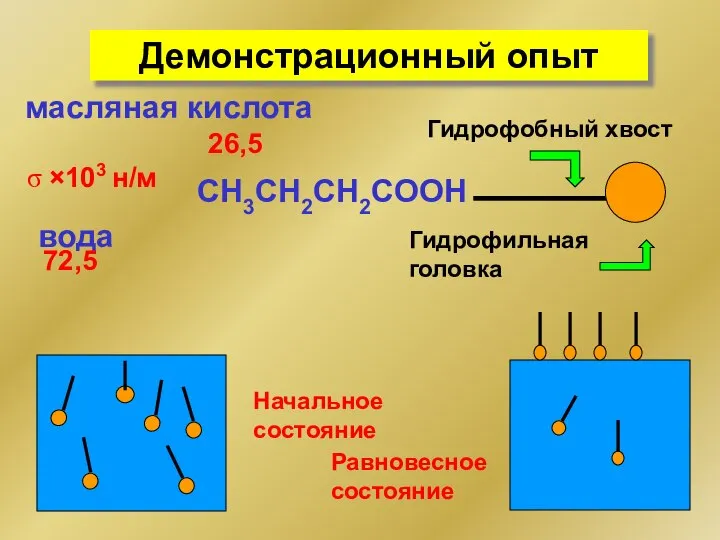
- 7. Демонстрационный опыт вода σ ×103 н/м 72,5 масляная кислота 26,5 Начальное состояние СH3CH2CH2COOH Гидрофобный хвост Гидрофильная
- 8. Адсорбция – самопроизвольный процесс накопления вещества на поверхности раздела фаз. Адсорбент – вещество, на котором происходит
- 9. Адсорбция Еактивации мала, Vадсорбции высокая Процесс самопроизвольный Процесс избирательный Первые исследования в области адсорбции – Т.Е.
- 10. Адсорбция в медицинской практике Физиотерапевтические процедуры – ванны, аппликации, обертывания Гемосорбция – удаление ядовитых веществ из
- 11. Pасчет адсорбции
- 12. Уравнения адсорбции Г = f(природа адсорбента/адсорбтива, С(Р), Т) Изотермы (T=const) адсорбции для твердых адсорбентов Уравнение Лэнгмюра
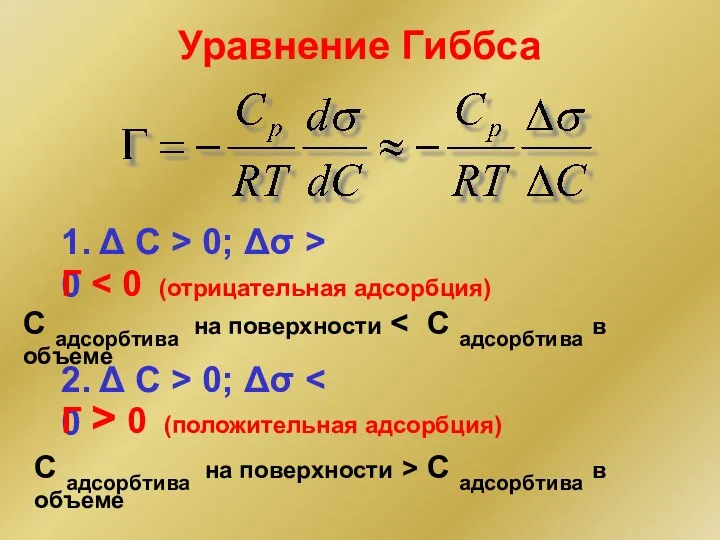
- 13. Уравнение Гиббса 1. Δ С > 0; Δσ > 0 Г С адсорбтива на поверхности 2.
- 14. неорганические соединения: кислоты, основания, соли. Для воды: Вещества, вызывающие положительную адсорбцию, называются поверхностно-активными веществами (ПАВ) Вещества,
- 15. ПАВ Полярные органические молекулы
- 16. С17Н35СООNa → С17Н35СОО- + Na+ Анионактивные ПАВ Алкилсульфаты С12Н25OSO3Na → С12Н25OSO3- + Na+ ПАВ Мыла Алкиларилсульфонаты
- 17. роккол Соли аммония и пиридиния Катионактивные ПАВ цетилпиридиний хлорид Неионногенные мыла C11H21-O-(CH2CH2O)8H
- 18. ПАВ Анионактивные ПАВ Мыла С17Н35СООNa → С17Н35СОО- + Na+ Катионактивные ПАВ Соли аммония и пиридиния Неионногенные
- 19. Применение ПАВ в медицине Моющие средства; дегазирующие средства. стабилизаторы лекарственных суспензий; эмульгаторы при стабилизации эмульсий для
- 20. Моющее действие ПАВ Грязь попала на руку. Ее удерживает на коже сила адсорбции. Струей воды грязь
- 21. Молекулы мыла связываются с поверхностью руки и грязью. Раствор мыла смачивает частицу. Моющее действие ПАВ
- 22. Моющее действие ПАВ Частица грязи отрывается от кожи и уносится струей воды, а мыло, адсорбирующееся на
- 23. Уравнение Лэнгмюра Нобелевская премия за работы по теории поверхностных явлений (1932) Г∞ - предельная адсорбция Г∞,
- 24. 1. Адсорбция происходит лишь на активных центрах поверхности. адсорбент Активные центры Основные положения адсорбат 2. Адсорбция
- 25. 3. Процесс адсорбции равновесен. Г∞ (предельная адсорбция) Общее число активных центров Vадс = Vдес Основные положения
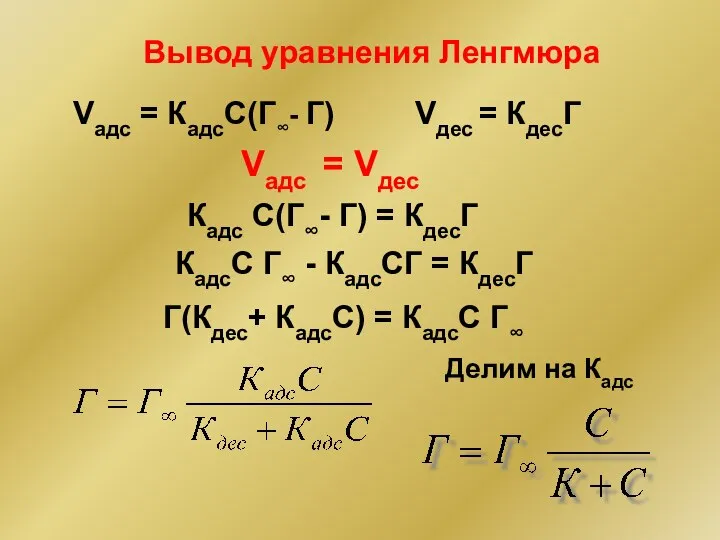
- 26. Вывод уравнения Ленгмюра Vадс = КадсС(Г∞- Г) Vдес = КдесГ Vадс = Vдес Делим на Кадс
- 27. I II III Г∞ Изотерма адсорбции I – область малых концентраций, С С>>K, тогда Г =
- 28. Расчет площади полярной «головки» молекулы ПАВ Для RCOOH S = 21 ×10-16 cм2
- 29. Уравнение Фрейндлиха Г(x/m) = aCn a, n – постоянные величины для данной пары адсорбент-адсорбтив Описывает процесс
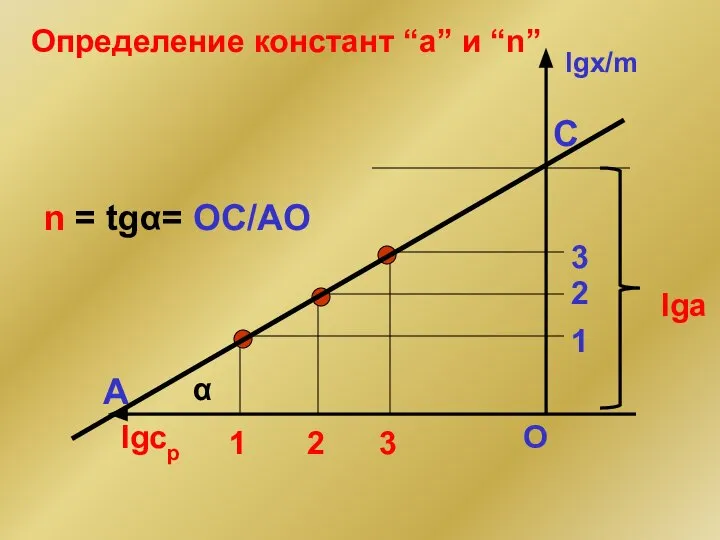
- 30. lgx/m lgcр 1 2 3 1 2 3 lga n = tgα= OC/AO α A O
- 31. Константы “a” и “n” (адсорбент - активированный уголь)
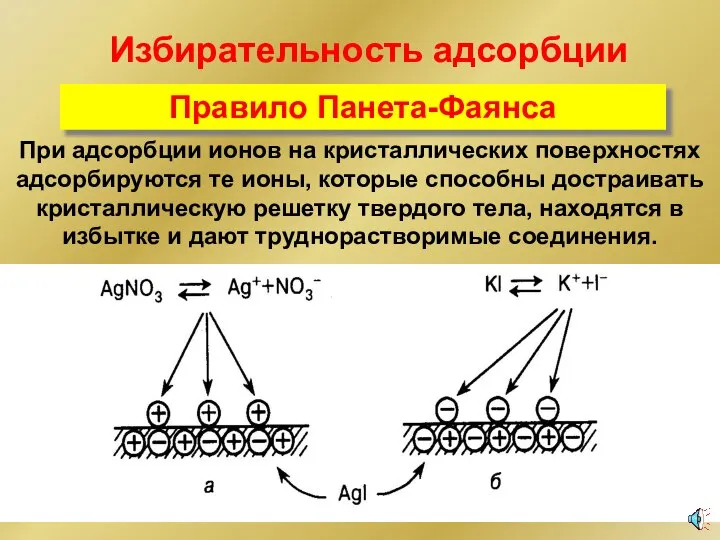
- 32. Избирательность адсорбции Правило Панета-Фаянса При адсорбции ионов на кристаллических поверхностях адсорбируются те ионы, которые способны достраивать
- 33. Избирательность адсорбции Многовалентные ионы адсорбируются сильнее одновалентных Способность к адсорбции одинаково заряженных ионов определяется их местом
- 34. Биологическое значение избирательной адсорбции Избирательная адсорбция токсинов тканями и клетками Токсины возбудителей столбняка поражают клетки центральной
- 35. Обменная адсорбция Явление замещения на адсорбенте одного вещества другим, находящимся во внешней среде. Ионообменная адсорбция Некоторые
- 36. Иониты 1 – каркас 2 – фиксированный ион 3 – подвижный ион, способный к ионному обмену
- 37. Иониты Катиониты Z-X Kat+y Z-X (каркас, с закрепленным анионом) Kat+y (катионы, способные к ионообмену) Аниониты Z+X
- 38. Иониты Природные: Алюмосиликаты (цеолиты, гидрослюда и др.) Древесина, торф, целлюлоза, сульфированные угли Синтетические: Алюмосиликаты (пермутиты) Органические
- 39. Цеолиты Атомы кислорода обозначены голубым, кремния или алюминия – сиреневым, натрия – красным цветом.
- 40. Натриево-силикатное стекло Атом кремния Атом кислорода Атом натрия x Na2O × y SiO2
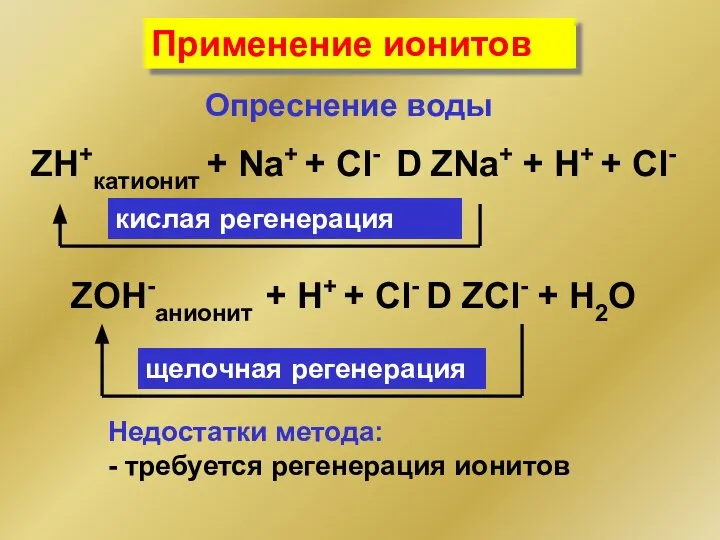
- 41. Применение ионитов Опреснение воды ZH+катионит + Na+ + Cl- D ZNa+ + H+ + Cl- ZOH-анионит
- 43. Скачать презентацию
































 Производство HNO3
Производство HNO3 Рентген-флуоресцентті талдау. Микроэлементтер талдауында қолдану
Рентген-флуоресцентті талдау. Микроэлементтер талдауында қолдану Полимеры. Классификация полимеров
Полимеры. Классификация полимеров Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Физико-химические процессы переработки нефти. Термические процессы
Физико-химические процессы переработки нефти. Термические процессы Жидкие кристаллы Подготовила: Кальченко Алёна
Жидкие кристаллы Подготовила: Кальченко Алёна  Ақуыздардың құрылысы мен қызыметі
Ақуыздардың құрылысы мен қызыметі Химия элементов. Лекция 1 Общая характеристика элементов IVA-группы. Углерод и кремний
Химия элементов. Лекция 1 Общая характеристика элементов IVA-группы. Углерод и кремний  Основы аналитической химии и физико - химических методов анализа
Основы аналитической химии и физико - химических методов анализа Диффузия и осмос
Диффузия и осмос Подготовка к контрольной работе «Неметаллы»
Подготовка к контрольной работе «Неметаллы» Химия: основные понятия
Химия: основные понятия Арены. Бензол
Арены. Бензол Сутек өндірісінің болашақ технологиясы - фотокатализ
Сутек өндірісінің болашақ технологиясы - фотокатализ Ionic and molecular compounds
Ionic and molecular compounds Презентация по Химии "ФУЛЛЕРЕНЫ И НАНОТРУБКИ" - скачать смотреть бесплатно
Презентация по Химии "ФУЛЛЕРЕНЫ И НАНОТРУБКИ" - скачать смотреть бесплатно Круговорот кислорода
Круговорот кислорода Фосфор
Фосфор Викторина Своя игра по химии
Викторина Своя игра по химии Химические уравнения. Типы химических реакций
Химические уравнения. Типы химических реакций Химическая связь и ее типы
Химическая связь и ее типы Контрольная работа №1
Контрольная работа №1 Смещение химического равновесия. Принцип Ле Шателье-Брауна
Смещение химического равновесия. Принцип Ле Шателье-Брауна Хімічні методи підвищення продуктивності свердловини
Хімічні методи підвищення продуктивності свердловини Кислотно-основное титрование
Кислотно-основное титрование Химическая связь
Химическая связь Презентация Лекарства дома
Презентация Лекарства дома Влияние шампуня на состояние волос человека
Влияние шампуня на состояние волос человека