Содержание
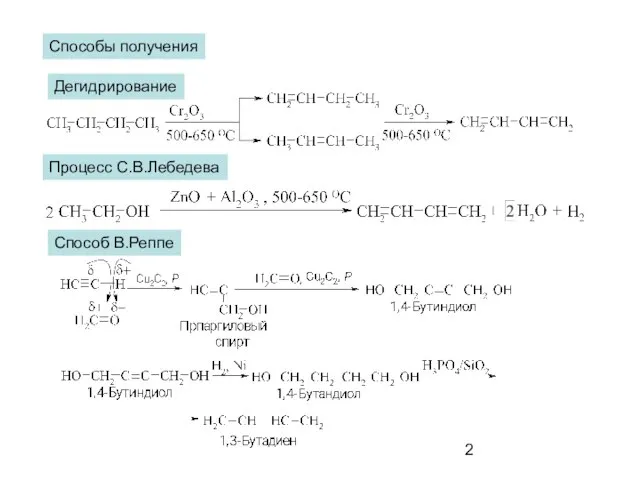
- 2. Способы получения Дегидрирование Процесс С.В.Лебедева Способ В.Реппе
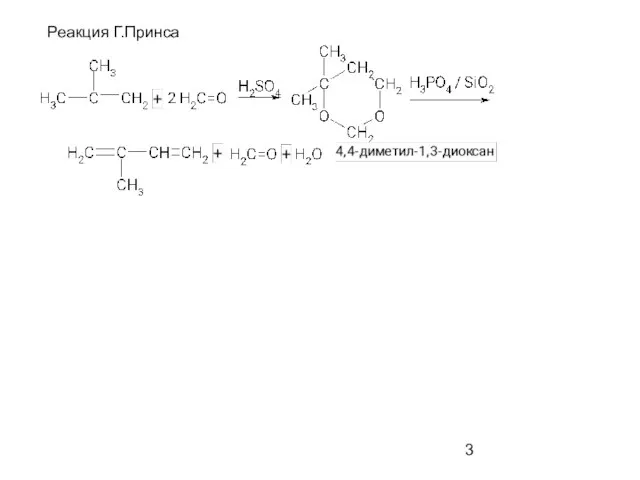
- 3. Реакция Г.Принса
- 4. Теплоты гидрирования алкенов и диенов Строение молекулы сопряженных диенов Рис. Влияние сопряжения на теплоту гидрирования
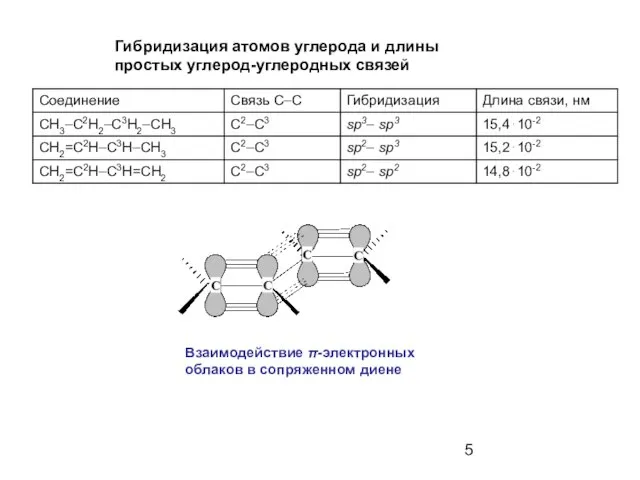
- 5. Гибридизация атомов углерода и длины простых углерод-углеродных связей Взаимодействие π-электронных облаков в сопряженном диене
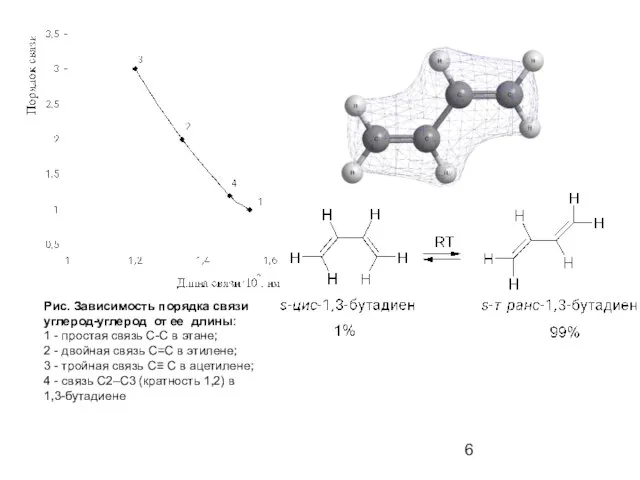
- 6. Рис. Зависимость порядка связи углерод-углерод от ее длины: 1 - простая связь С-С в этане; 2
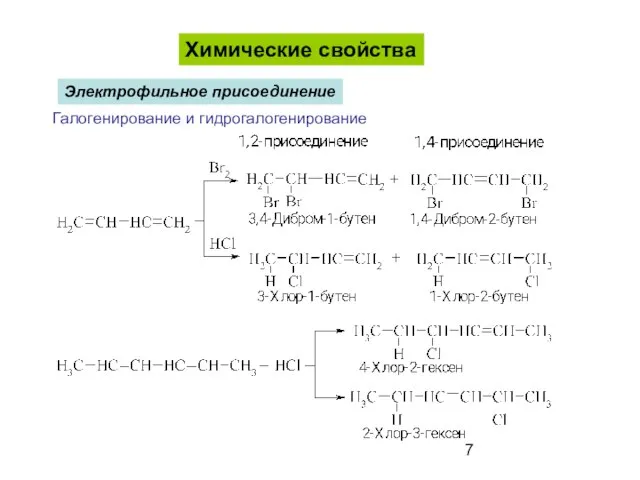
- 7. Химические свойства Галогенирование и гидрогалогенирование Электрофильное присоединение
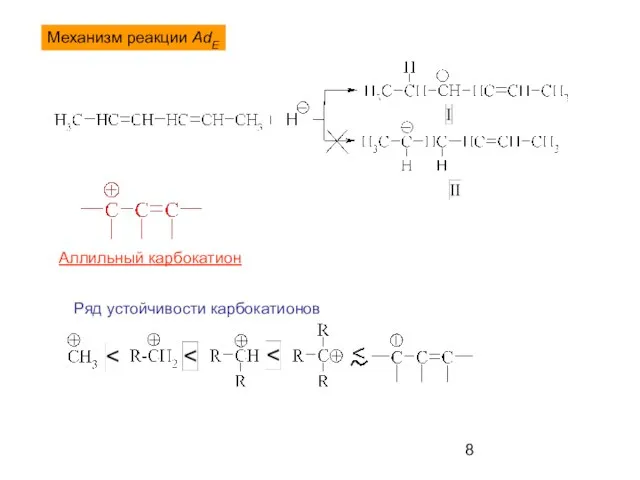
- 8. Механизм реакции AdE Аллильный карбокатион Ряд устойчивости карбокатионов
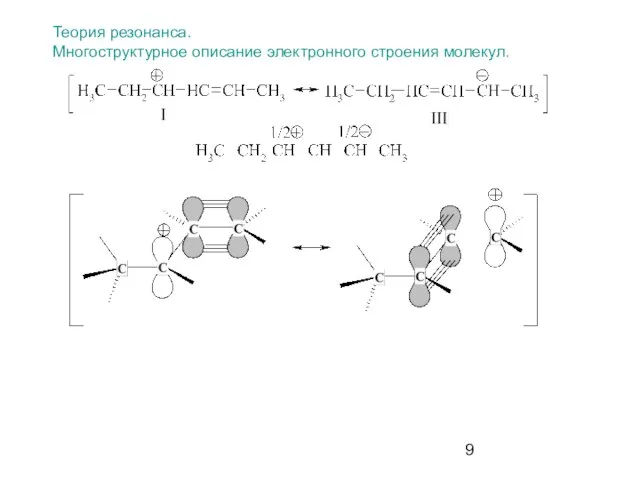
- 9. Теория резонанса. Многоструктурное описание электронного строения молекул.
- 10. Если молекула может быть представлена двумя или более структурами, в которых атомные ядра соединены одинаково, а
- 11. Энергия реальной молекулы (резонансного гибрида) меньше, чем энергия любой из граничных структур. Вклад отдельных канонических структур
- 12. Правила построения граничных структур. 1) Резонансные (граничные или канонические) структуры реально не существуют, но они позволяют
- 13. При перемещении электронов помещайте отрицательный заряд на более электроотрицательный атом. Структуры с неполным зарядом на любом
- 14. 4) Энергия реальной молекулы ниже, чем энергия любой граничной структуры. Аллильный катион, например, более устойчив, чем
- 15. Механизм реакции AdE
- 16. 1,2- и 1,4-Присоединение. Кинетический контроль, термодинамический контроль.
- 17. при -80 °С образуется кинетически контролируемый продукт реакции Рис. Кинетический и термодинамический контроль в реакции присоединения
- 18. при 40 °С образуется термодинамически контролируемый продукт реакции Термодинамически контролируемый продукт – это более устойчивый продукт,
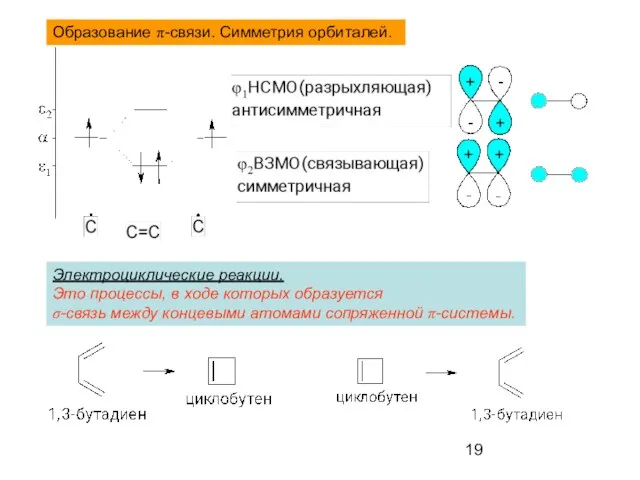
- 19. Образование π-связи. Симметрия орбиталей. Электроциклические реакции. Это процессы, в ходе которых образуется σ-связь между концевыми атомами
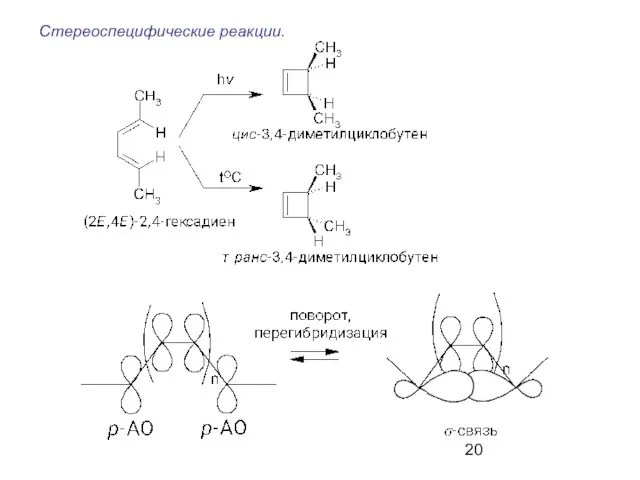
- 20. Стереоспецифические реакции.
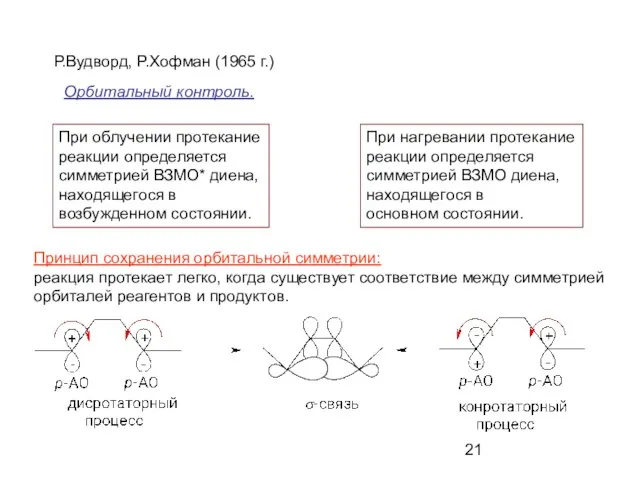
- 21. Р.Вудворд, Р.Хофман (1965 г.) Принцип сохранения орбитальной симметрии: реакция протекает легко, когда существует соответствие между симметрией
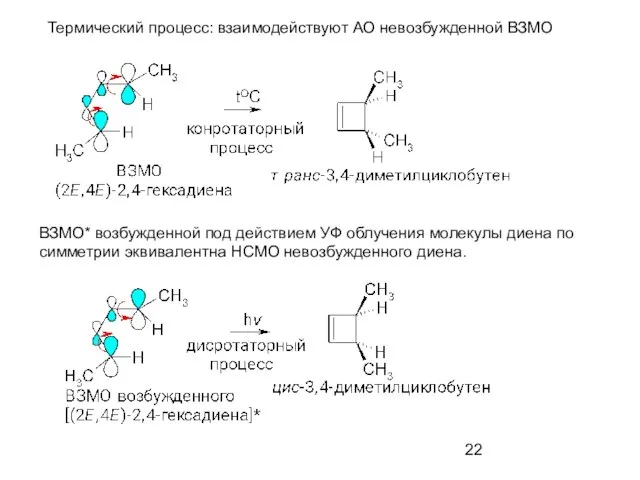
- 22. ВЗМО* возбужденной под действием УФ облучения молекулы диена по симметрии эквивалентна НСМО невозбужденного диена. Термический процесс:
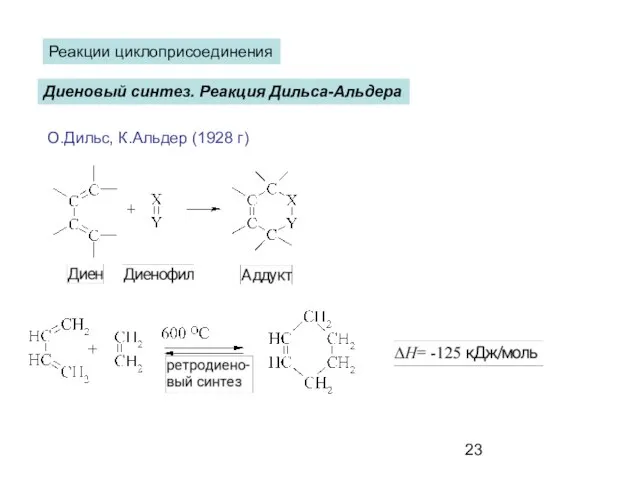
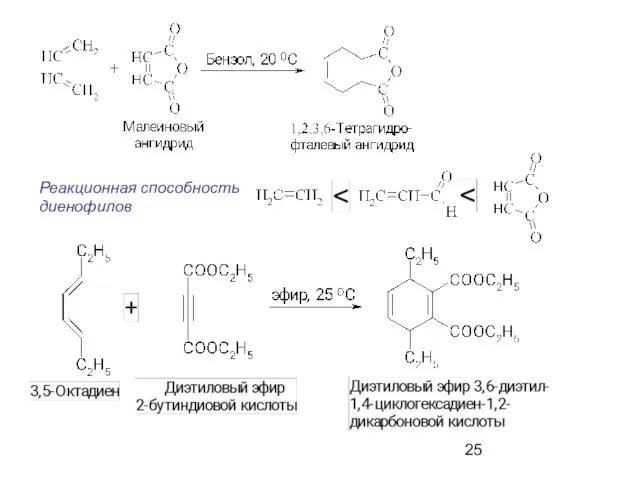
- 23. Диеновый синтез. Реакция Дильса-Альдера Реакции циклоприсоединения О.Дильс, К.Альдер (1928 г)
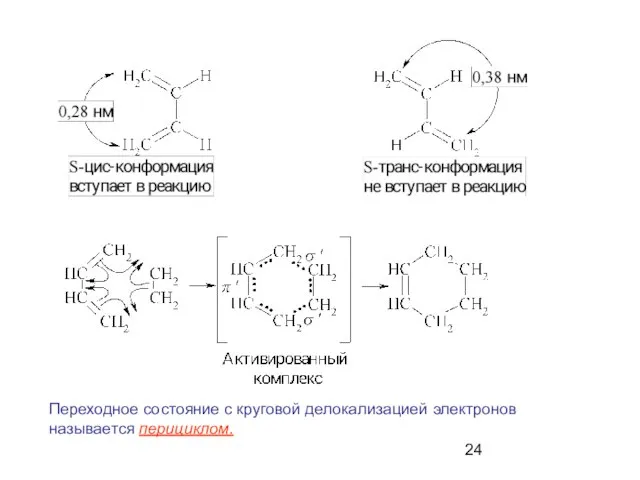
- 24. Переходное состояние с круговой делокализацией электронов называется перициклом.
- 25. Реакционная способность диенофилов
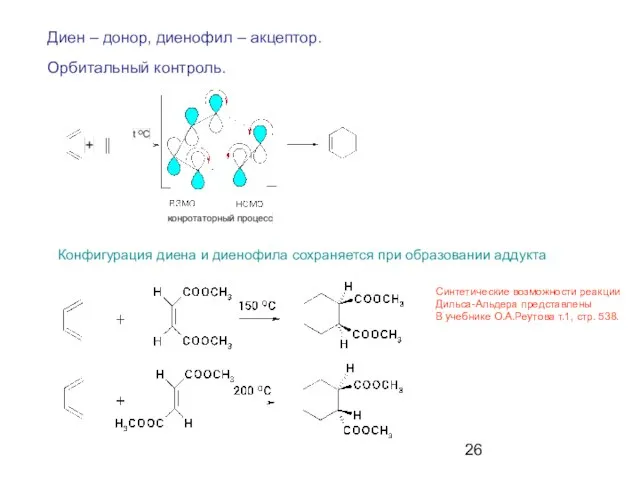
- 26. Диен – донор, диенофил – акцептор. Орбитальный контроль. Конфигурация диена и диенофила сохраняется при образовании аддукта
- 27. Полимеризация
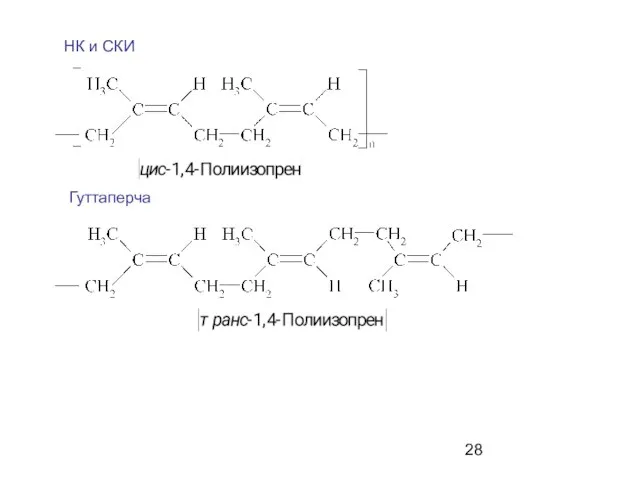
- 28. НК и СКИ Гуттаперча
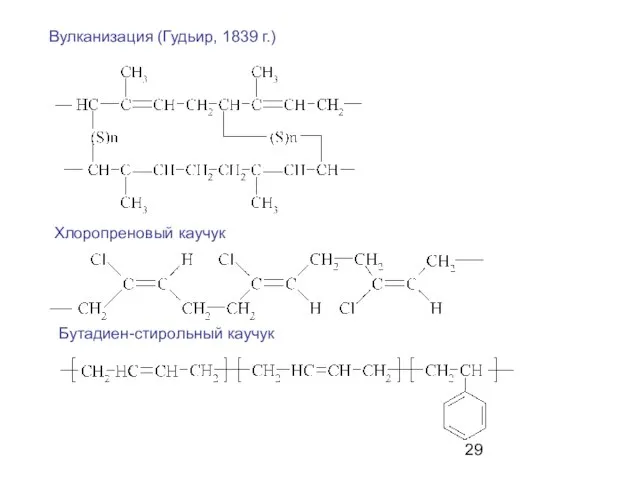
- 29. Вулканизация (Гудьир, 1839 г.) Хлоропреновый каучук Бутадиен-стирольный каучук
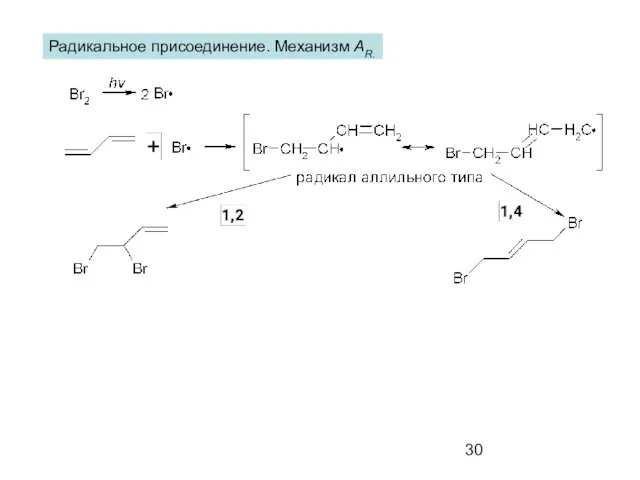
- 30. Радикальное присоединение. Механизм AR.
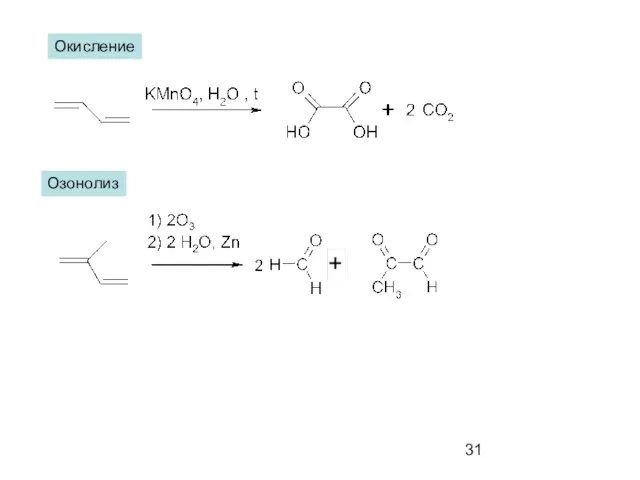
- 31. Окисление Озонолиз
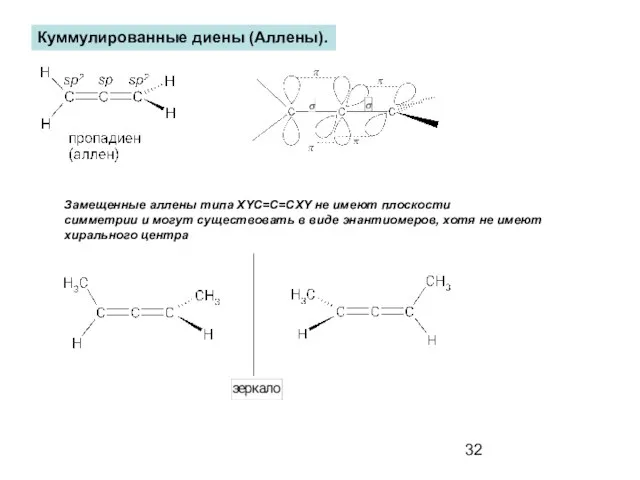
- 32. Куммулированные диены (Аллены). Замещенные аллены типа XYC=C=CXY не имеют плоскости симметрии и могут существовать в виде
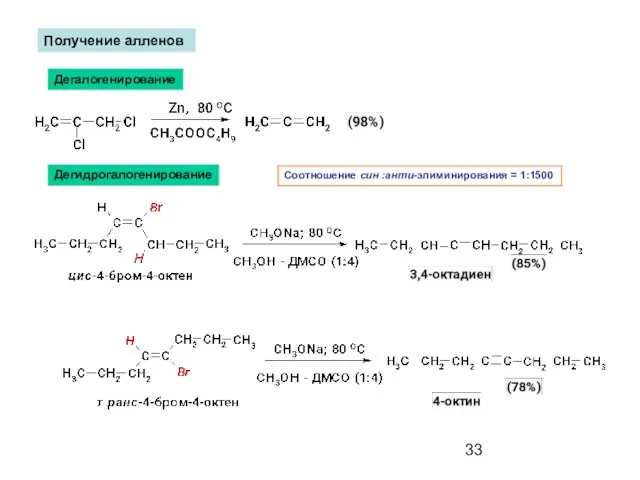
- 33. Получение алленов Дегалогенирование Дегидрогалогенирование Соотношение син :анти-элиминирования = 1:1500
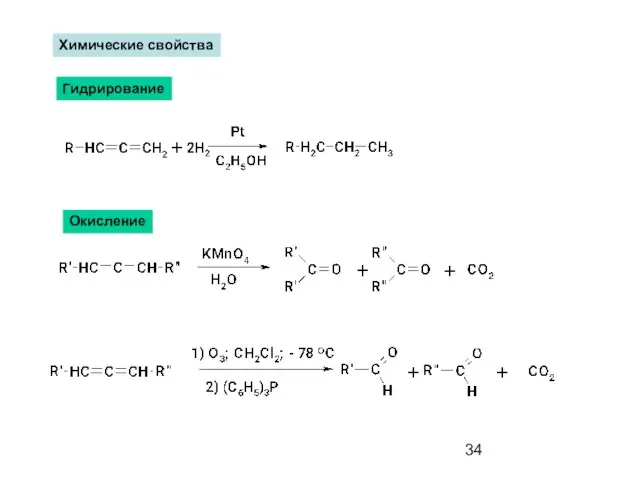
- 34. Химические свойства Гидрирование Окисление
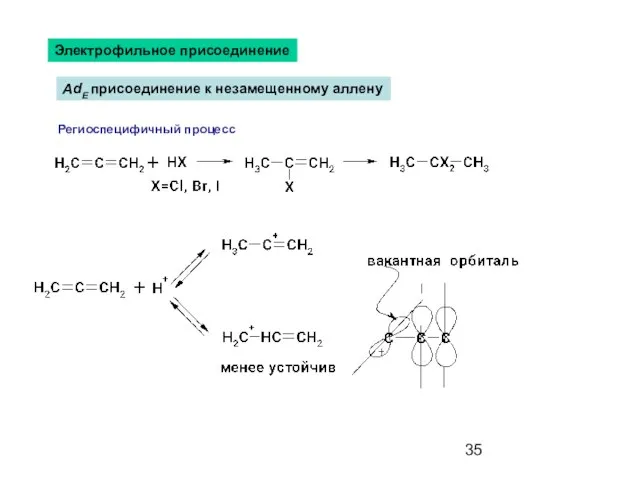
- 35. Электрофильное присоединение AdE присоединение к незамещенному аллену Региоспецифичный процесс
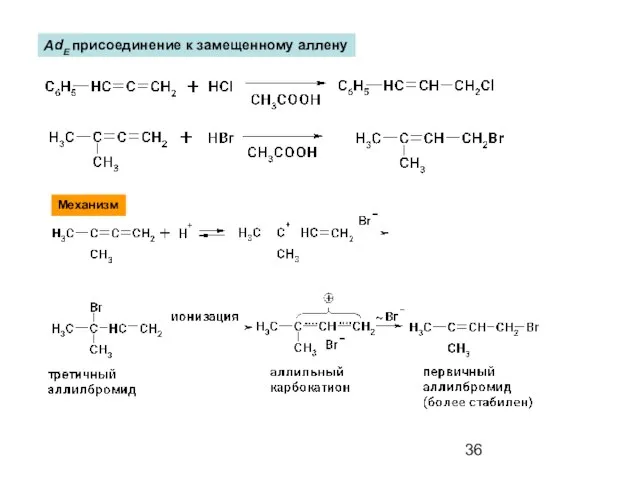
- 36. AdE присоединение к замещенному аллену Механизм
- 38. Скачать презентацию











 Опасные химикаты
Опасные химикаты Катализаторы
Катализаторы Експерементально - дослідницький проект “Дослідження якості плавлених сирків” Підготували учасники хімічного гуртка “Безпека харчування” під керівництвом вчителя хімії та біології Караваєнко Е.Б.
Експерементально - дослідницький проект “Дослідження якості плавлених сирків” Підготували учасники хімічного гуртка “Безпека харчування” під керівництвом вчителя хімії та біології Караваєнко Е.Б. Металлы. Урок – обобщения
Металлы. Урок – обобщения Підготував Учень 10-а класу СШ№28 Прядко Андрій
Підготував Учень 10-а класу СШ№28 Прядко Андрій  Водородный показатель - рН
Водородный показатель - рН Натрий. Роль натрия в организме
Натрий. Роль натрия в организме Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Электролитическая диссоциация
Электролитическая диссоциация Минерал как химическое соединение
Минерал как химическое соединение Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов
Положение металлов в ПСХЭ Д.И. Менделеева. Общие физические свойства металлов Презентация по Химии "кпк" - скачать смотреть бесплатно
Презентация по Химии "кпк" - скачать смотреть бесплатно Анод + Катод = Электролиз Выполнил: ученик 11М класса МОУ лицея №6 Аббязов Эрик
Анод + Катод = Электролиз Выполнил: ученик 11М класса МОУ лицея №6 Аббязов Эрик Гемоглобин. Структура и свойства молекулы гемоглобина
Гемоглобин. Структура и свойства молекулы гемоглобина Обмен липидов
Обмен липидов Химиялық реакцияның жылдамдығы. Катализ
Химиялық реакцияның жылдамдығы. Катализ Факторы, определяющие развитие отравлений
Факторы, определяющие развитие отравлений Показатель концентрации водородных ионов (лекция 6)
Показатель концентрации водородных ионов (лекция 6) Оборудование для дистилляции мисцеллы
Оборудование для дистилляции мисцеллы Химические формулы
Химические формулы Ароматичні речовини
Ароматичні речовини Ди- және полисахаридтер
Ди- және полисахаридтер Вода. Физические и химические свойства
Вода. Физические и химические свойства Фосфор и его соединения
Фосфор и его соединения Неорганические вещества клетки
Неорганические вещества клетки Презентация по Химии "ВУГЛЕВОДИ" - скачать смотреть бесплатно
Презентация по Химии "ВУГЛЕВОДИ" - скачать смотреть бесплатно Химические свойства оксидов
Химические свойства оксидов Гормоны коркового вещества надпочечников кортикостероиды
Гормоны коркового вещества надпочечников кортикостероиды