Содержание
- 2. Электролитическая диссоциация химических элементов Лабораторный опыт 1 В первую сухую пробирку налить концентрированной серной кислоты и
- 3. Электролитическая диссоциация химических элементов Лабораторный опыт 2 В две сухие пробирки насыпать немного кристаллического гидроксида кальция
- 4. Электролитическая диссоциация химических элементов Лабораторный опыт 3 В две пробирки насыпать обезвоженный сульфат меди. В одну
- 5. Электролитическая диссоциация химических элементов Демонстрационный эксперимент.
- 6. Электролитическая диссоциация химических элементов
- 7. Электролитическая диссоциация химических элементов
- 8. Электролитическая диссоциация химических элементов
- 9. Электролитическая диссоциация химических элементов Основные положения теории: 1. Электролиты при растворении в воде распадаются (диссоциируют) на
- 10. Электролитическая диссоциация химических элементов Основные положения теории: 2. При действии электрического тока ионы приобретают направленное движение:
- 11. Электролитическая диссоциация химических элементов Основные положения теории: 3. Диссоциация – обратимый процесс: параллельно с распадом молекул
- 12. Электролитическая диссоциация химических элементов
- 13. Электролитическая диссоциация химических элементов Механизм диссоциации веществ.
- 14. Электролитическая диссоциация химических элементов Кислоты диссоциируют на ионы водорода и кислотного остатка. - HCI = Н+
- 15. Электролитическая диссоциация химических элементов Соли диссоциируют на ионы металла и кислотного остатка + - NaCI =
- 16. Электролитическая диссоциация химических элементов Основания диссоциируют на ионы металла и гидроксид-ионы + - Na OH =
- 17. Электролитическая диссоциация химических элементов Домашнее задание: Написать уравнения диссоциации: Сернистой кислоты, фосфорной кислоты, бромоводородной кислоты, гидроксида
- 19. Скачать презентацию
















 Предмет органической химии. Теория строения органических веществ А.М. Бутлерова
Предмет органической химии. Теория строения органических веществ А.М. Бутлерова Строение атома, изотопы
Строение атома, изотопы Некоторые структурные особенности макромолекул
Некоторые структурные особенности макромолекул Химический брейн-ринг
Химический брейн-ринг Химические свойства воды
Химические свойства воды Лаборатория в домашних условиях. Мастер-класс
Лаборатория в домашних условиях. Мастер-класс Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Неорганические вещества клетки
Неорганические вещества клетки Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша) Типы ингибирования и их характерные черты
Типы ингибирования и их характерные черты Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия
Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия Актуальные проблемы газовой отрасли России
Актуальные проблемы газовой отрасли России  Современные представления о происхождении нефти и газа
Современные представления о происхождении нефти и газа Операции термической обработки
Операции термической обработки Цирконий. Схема получения чистого циркония
Цирконий. Схема получения чистого циркония Изучаем химию с Агатой Кристи
Изучаем химию с Агатой Кристи Минеральные вещества
Минеральные вещества Функциональные производные с простой связью C-“Э”. Часть 4 …окси-производные
Функциональные производные с простой связью C-“Э”. Часть 4 …окси-производные Пурины. Строение пурина
Пурины. Строение пурина Неметаллы. Аллотропия. Куцапкина Людмила Васильевна учитель химии ГБОУ гимназии № 343 Невского района Санкт- Петербурга
Неметаллы. Аллотропия. Куцапкина Людмила Васильевна учитель химии ГБОУ гимназии № 343 Невского района Санкт- Петербурга Биоэлементы для животных и людей
Биоэлементы для животных и людей Химическое равновесие. Автор: Фельдман Людмила Валентиновна, учитель химии МБОУ СОШ им. А.М.Горького г.Карачева Брянской области
Химическое равновесие. Автор: Фельдман Людмила Валентиновна, учитель химии МБОУ СОШ им. А.М.Горького г.Карачева Брянской области Дисперсті жүйелердің оптикалық әдістері
Дисперсті жүйелердің оптикалық әдістері Современная система контроля и обеспечения качества лекарственных средств в Украине
Современная система контроля и обеспечения качества лекарственных средств в Украине «Голубое золото» 10 класс базовый уровень
«Голубое золото» 10 класс базовый уровень 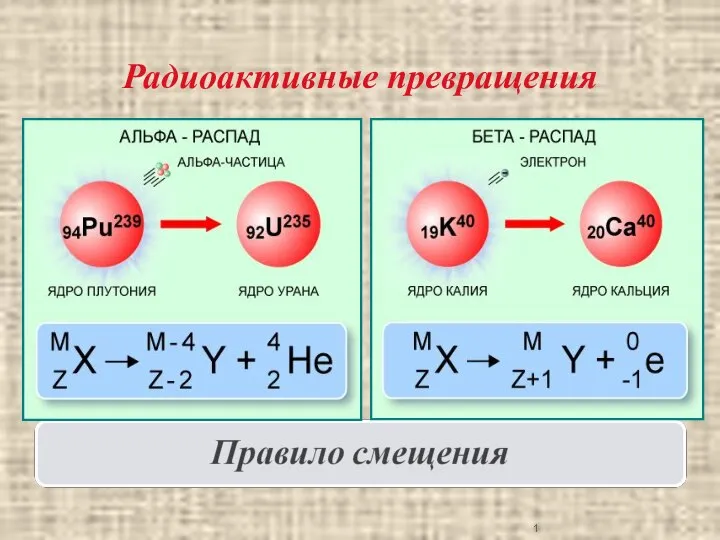 Правило смещения. Радиоактивность. Изотопы
Правило смещения. Радиоактивность. Изотопы Пентозний шлях
Пентозний шлях Комплексные соединения
Комплексные соединения