Содержание
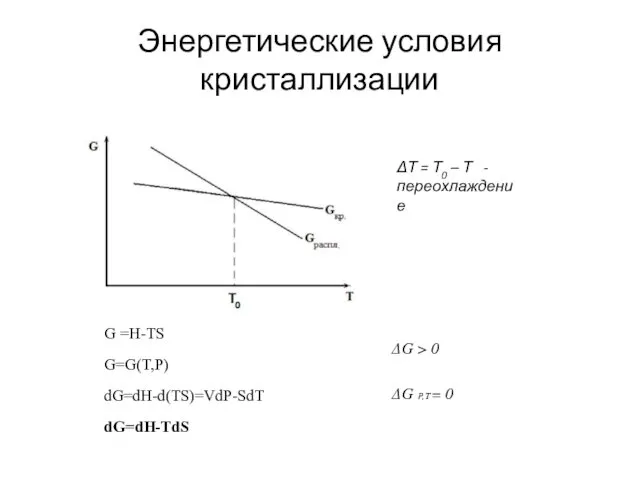
- 2. Энергетические условия кристаллизации ΔТ = Т0 – Т - переохлаждение G =H-TS G=G(T,P) dG=dH-d(TS)=VdP-SdT dG=dH-TdS ΔG
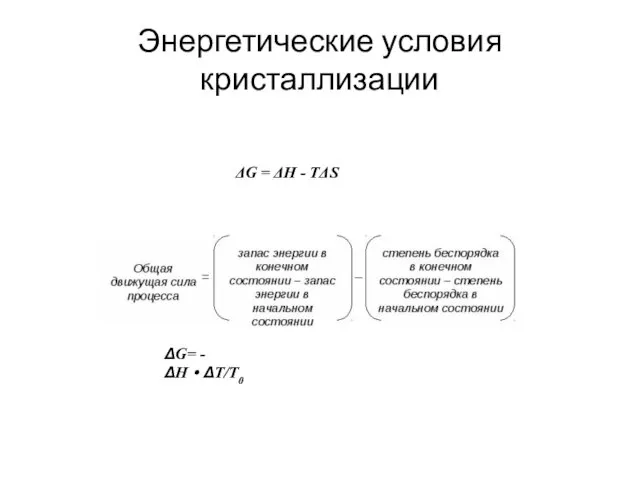
- 3. Энергетические условия кристаллизации ΔG = ΔH - TΔS ΔG= - ΔH·ΔT/T0
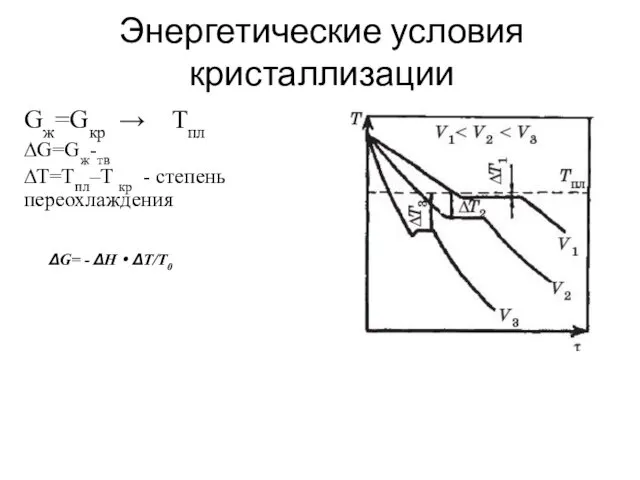
- 4. Энергетические условия кристаллизации Gж=Gкр → Tпл ∆G=Gж-тв ∆T=Tпл–T кр - степень переохлаждения ΔG= - ΔH·ΔT/T0
- 5. Энергетические условия кристаллизации ΔT=T-T0 - переохлаждение ΔP=P-P0 – пересыщение Δс=с-с0 - пересыщение
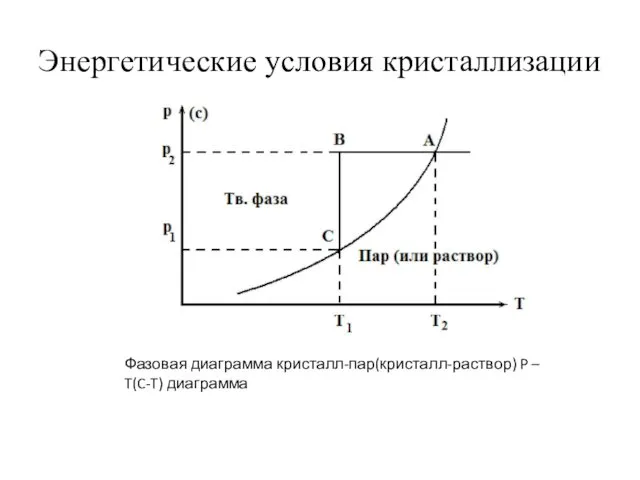
- 6. Энергетические условия кристаллизации Фазовая диаграмма кристалл-пар(кристалл-раствор) P – T(C-T) диаграмма
- 7. Энергетические условия кристаллизации Фаза – однородная часть, характеризующаяся определенным составом, кристаллической решеткой и отделенная от других
- 8. Эвтектика греч. éutektos — легкоплавящийся) — нонвариантная (при постоянном давлении) точка в системе из n компонентов,
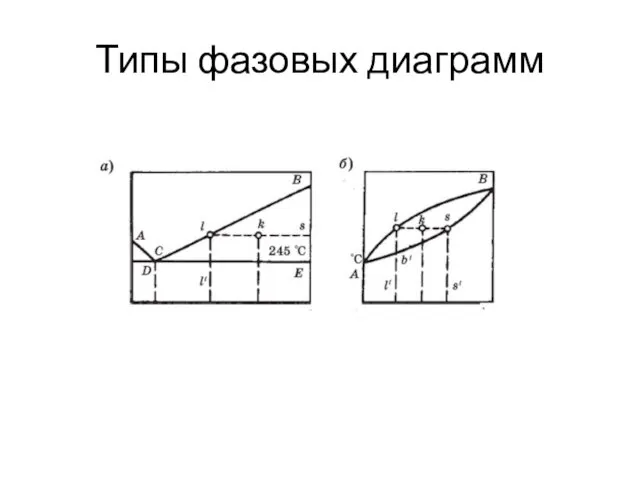
- 9. Типы фазовых диаграмм
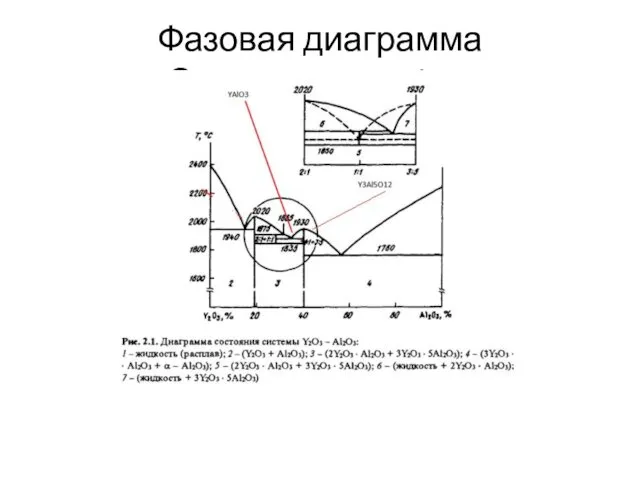
- 10. Фазовая диаграмма Системы Y2O3-Al2O3
- 11. Кинетика кристаллизации Гиббс – теория зарождения центров кристаллизации. Переход из неравновесного(метастабильного) состояния Метастабильное состояние – появление
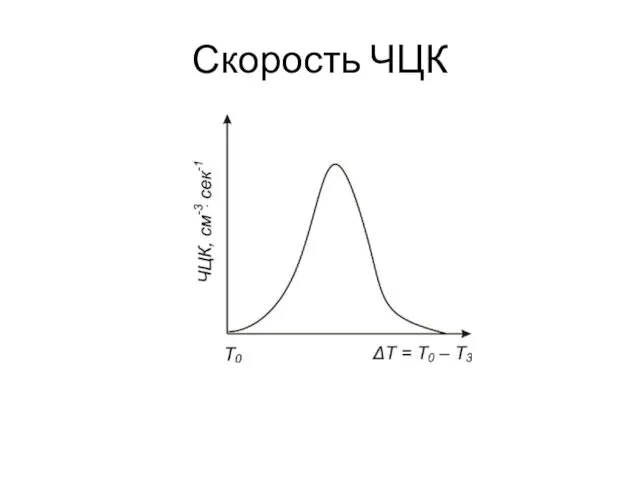
- 12. Скорость ЧЦК
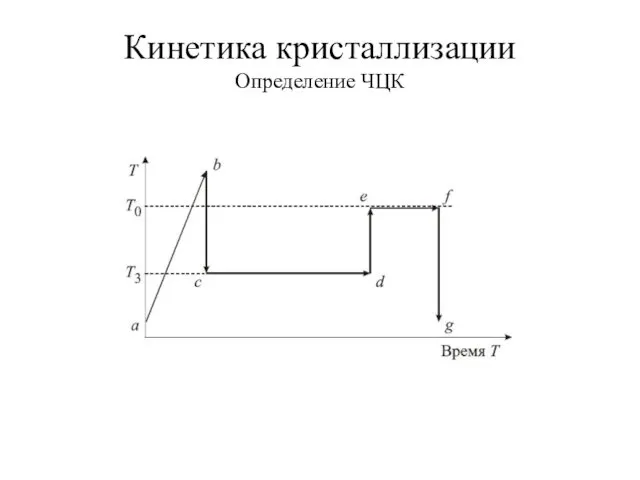
- 13. Кинетика кристаллизации Определение ЧЦК
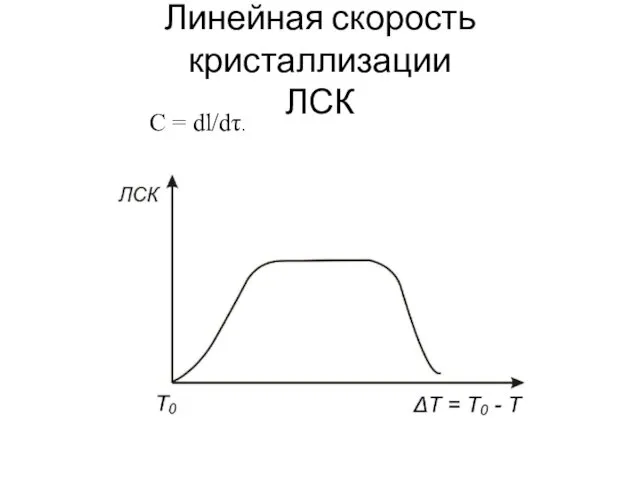
- 14. Линейная скорость кристаллизации ЛСК С = dl/dτ.
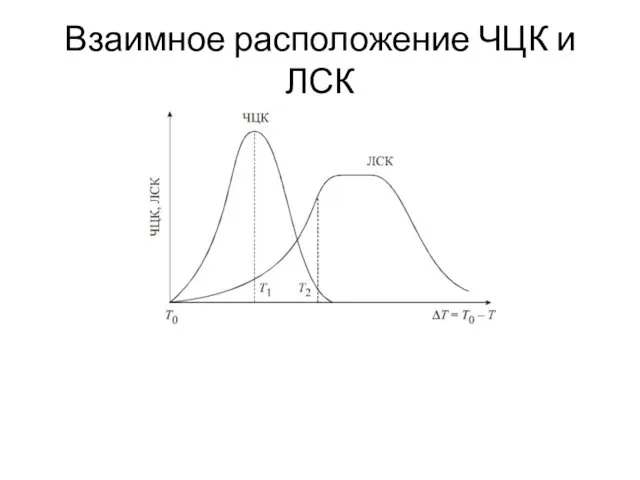
- 15. Взаимное расположение ЧЦК и ЛСК
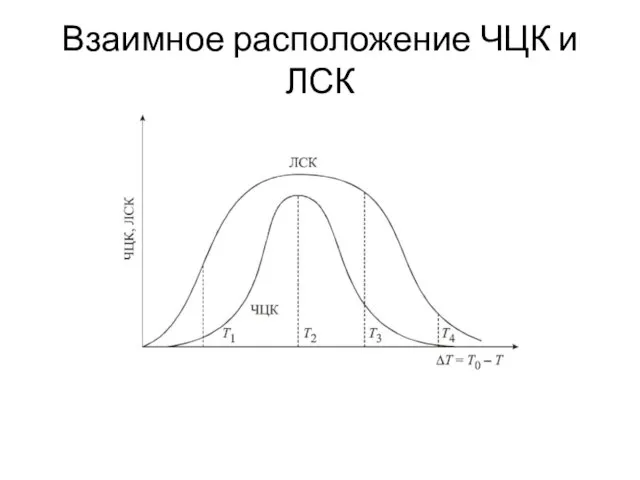
- 16. Взаимное расположение ЧЦК и ЛСК
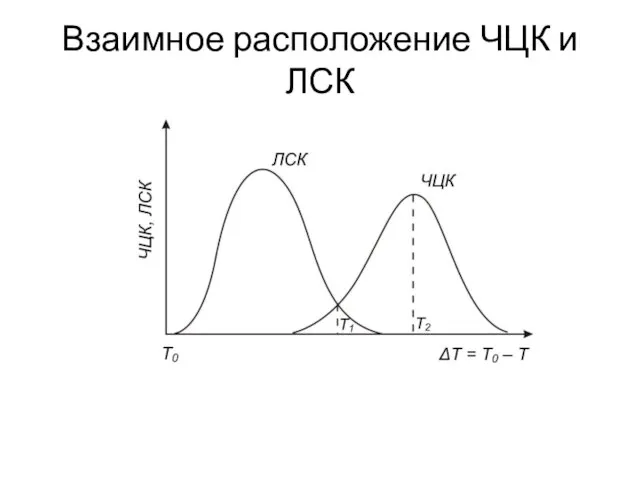
- 17. Взаимное расположение ЧЦК и ЛСК
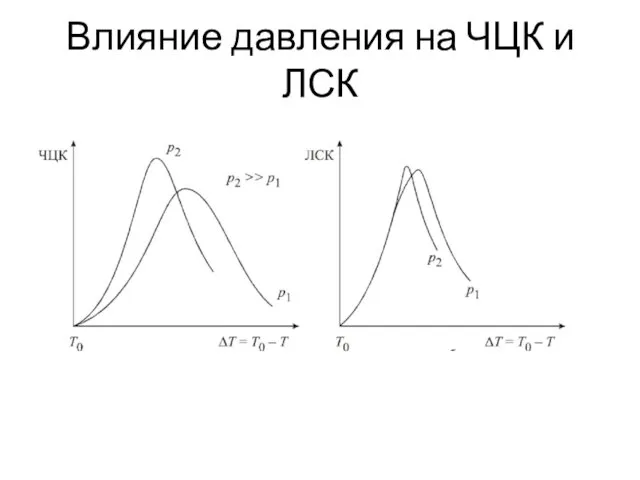
- 18. Влияние давления на ЧЦК и ЛСК
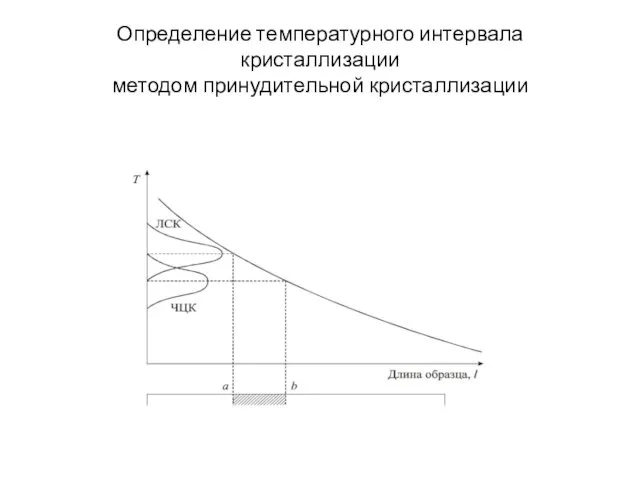
- 19. Определение температурного интервала кристаллизации методом принудительной кристаллизации
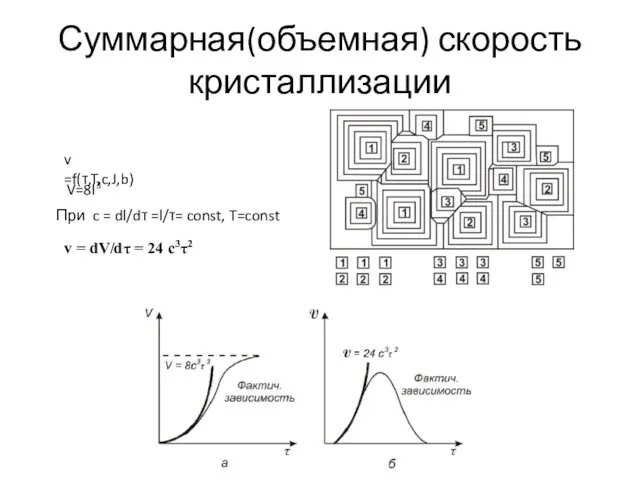
- 20. Суммарная(объемная) скорость кристаллизации v =f(τ,T,c,J,b) V=8l3 При c = dl/dτ =l/τ= const, T=const v = dV/dτ
- 21. Огранка кристалла и скорость роста граней Vc>Vb>Va Vc : Va = 3 Анизотропия скорости роста кристалла
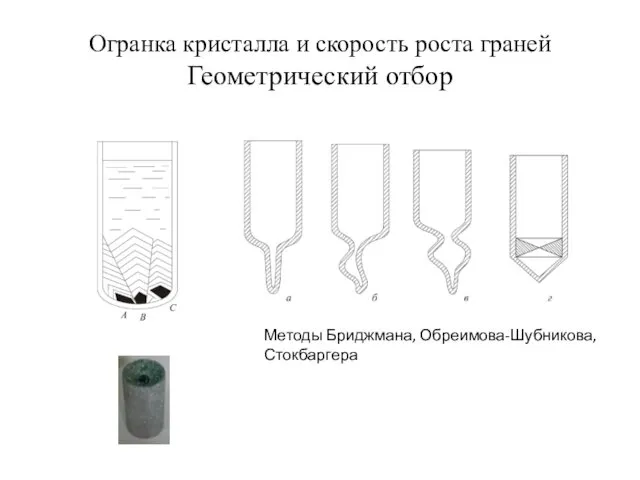
- 22. Огранка кристалла и скорость роста граней Геометрический отбор Методы Бриджмана, Обреимова-Шубникова, Стокбаргера
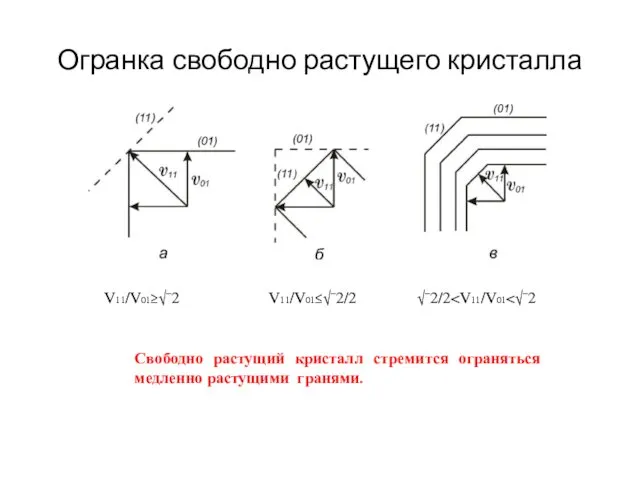
- 23. Огранка свободно растущего кристалла V11/V01≥√¯2 V11/V01≤√¯2/2 √¯2/2 Свободно растущий кристалл стремится ограняться медленно растущими гранями.
- 24. Огранка свободно растущего кристалла
- 25. Огранка свободно растущего кристалла
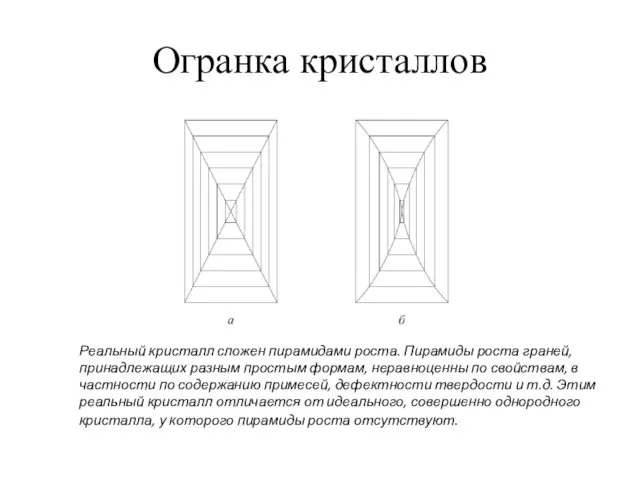
- 26. Огранка кристаллов Реальный кристалл сложен пирамидами роста. Пирамиды роста граней, принадлежащих разным простым формам, неравноценны по
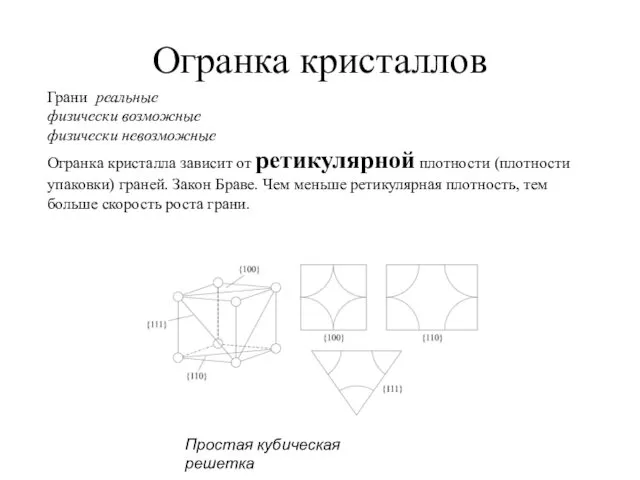
- 27. Огранка кристаллов Грани реальные физически возможные физически невозможные Огранка кристалла зависит от ретикулярной плотности (плотности упаковки)
- 28. Огранка кристаллов Объемноцентрированая решетка. Максимальная ретикулярная плотность для грани [110]
- 29. Огранка кристаллов Гранецентрированная решетка . Максимальная ретикулярная плотность для грани [110]
- 30. Огранка кристаллов Форм роста много Равновесная форма кристалла одна . Образована плотноупакованным гранями Пример. Алмаз.Равновесная форма
- 31. Огранка кристаллов Принцип Гиббса-Вульфа- Кюри Принцип Гиббса-Вульфа-Кюри. Равновесная форма кристалла соответствует минимуму свободной объемной и поверхностной
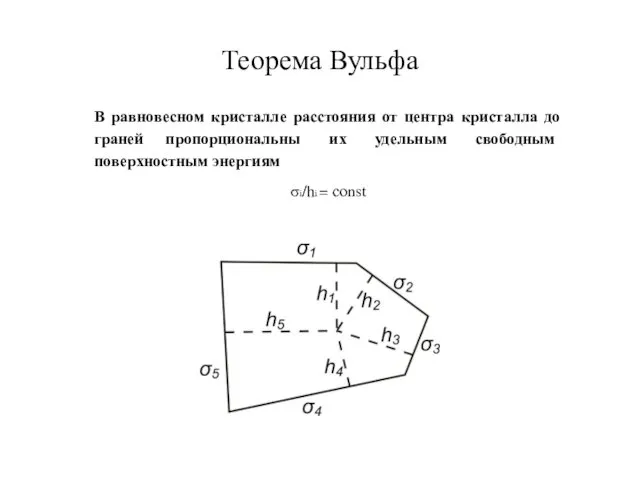
- 32. Теорема Вульфа σi/hi = const В равновесном кристалле расстояния от центра кристалла до граней пропорциональны их
- 33. Метод Шубникова определения равновесной формы кристалла С медленно растущих граней, принадлежащих равновесной, форме, при растворении удаляется
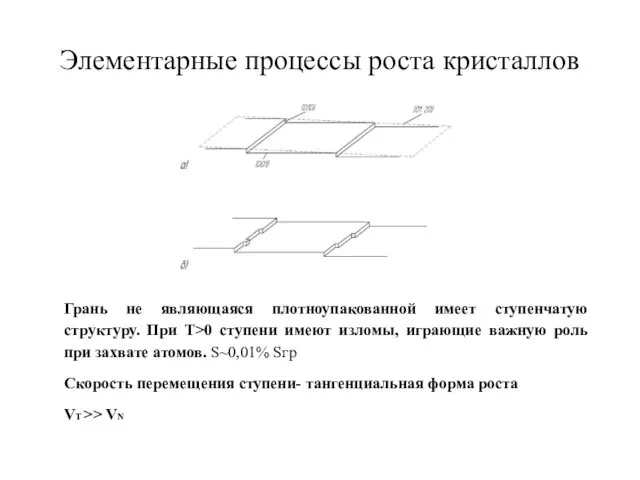
- 34. Элементарные процессы роста кристаллов Грань не являющаяся плотноупакованной имеет ступенчатую структуру. При T>0 ступени имеют изломы,
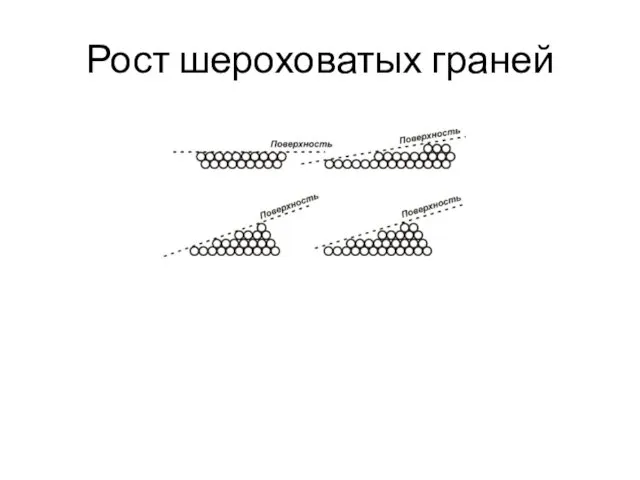
- 35. Рост шероховатых граней
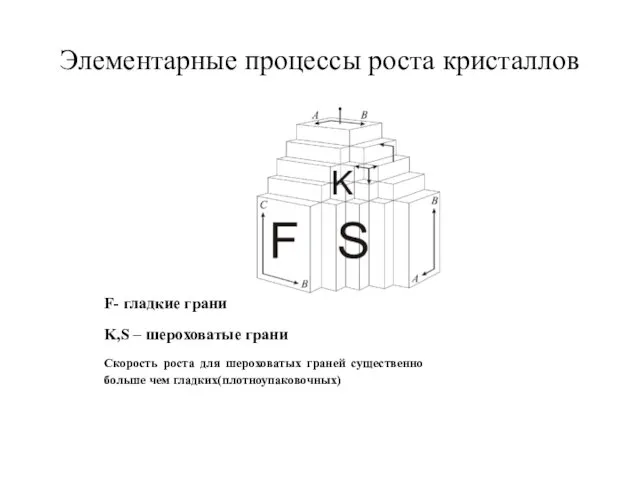
- 36. Элементарные процессы роста кристаллов F- гладкие грани K,S – шероховатые грани Скорость роста для шероховатых граней
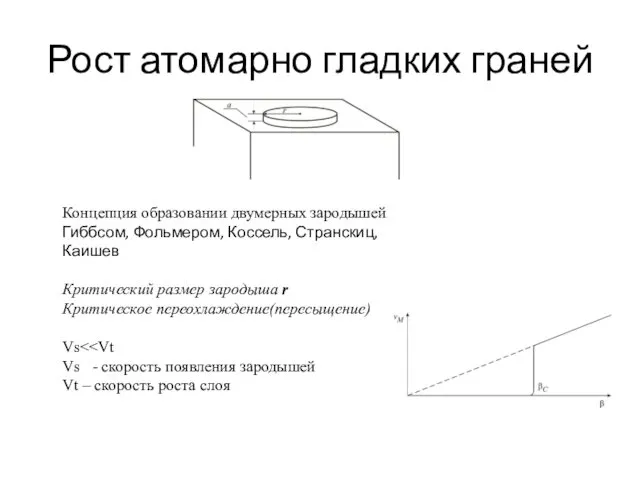
- 37. Рост атомарно гладких граней Концепция образовании двумерных зародышей Гиббсом, Фольмером, Коссель, Странскиц, Каишев Критический размер зародыша
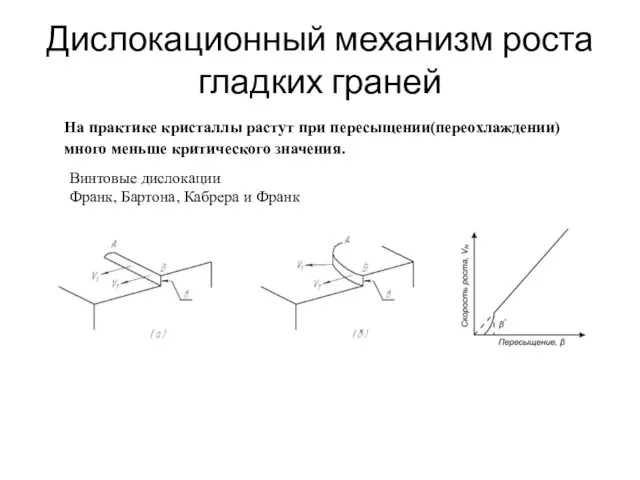
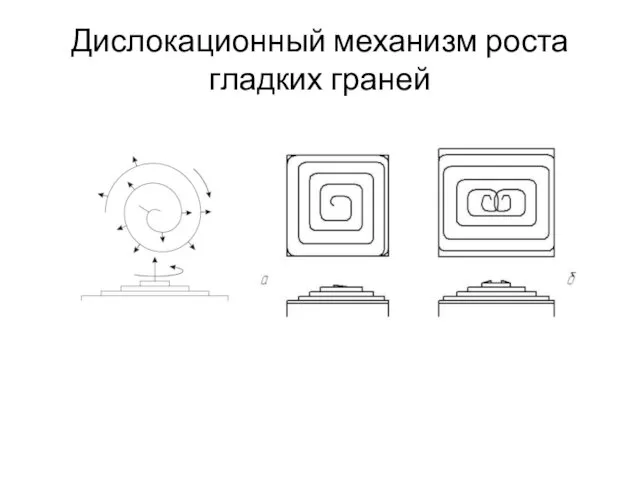
- 38. Дислокационный механизм роста гладких граней Винтовые дислокации Франк, Бартона, Кабрера и Франк На практике кристаллы растут
- 39. Дислокационный механизм роста гладких граней
- 40. Установка «Гранат-2», компоненты теплового узла и Компоненты теплового узла: 1 — нагревательный элемент, 2 — блок
- 41. Монокристалл алюмо-иттриевого граната, легированного ванадием
- 42. Срезы були алюмоиттриевого граната с ванадием а,б,в — срез кристалла (просветленная пластина), г — готовое изделие
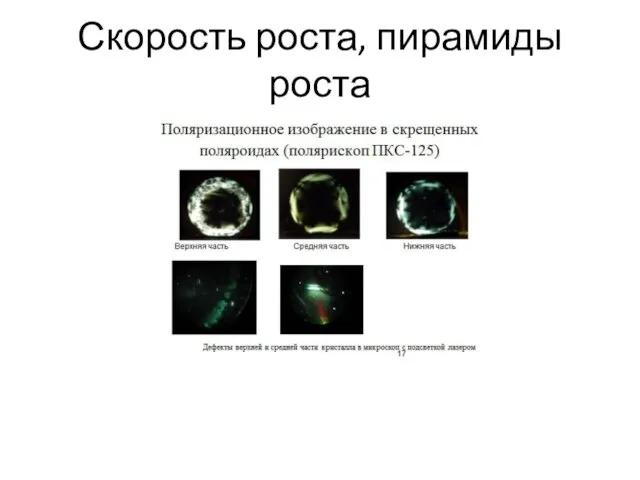
- 43. Скорость роста, пирамиды роста
- 44. Свойства кристаллов соединений Al2O3-Y2O3
- 46. Скачать презентацию






![Огранка кристаллов Объемноцентрированая решетка. Максимальная ретикулярная плотность для грани [110]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447571/slide-27.jpg)
![Огранка кристаллов Гранецентрированная решетка . Максимальная ретикулярная плотность для грани [110]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/447571/slide-28.jpg)







 Кобальт. Нахождение в природе. Получение
Кобальт. Нахождение в природе. Получение Окисно-відновні реакції, їхнє значення. Процеси окиснення, відновлення, окисники, відновники.
Окисно-відновні реакції, їхнє значення. Процеси окиснення, відновлення, окисники, відновники.  Влияние инициаторов на реакцию полимеризации стирола
Влияние инициаторов на реакцию полимеризации стирола Метод крутого восхождения или метод Бокса-Уилсона. Симплексный метод оптимизации
Метод крутого восхождения или метод Бокса-Уилсона. Симплексный метод оптимизации Кремний
Кремний Гидрокарбонат натрия NaHCO₃
Гидрокарбонат натрия NaHCO₃ Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов Полисахариды. Крахмал. Целлюлоза
Полисахариды. Крахмал. Целлюлоза Даны буквы: Р, З, И, О, А, П, Т, М. В этих буквах спрятано название элемента, про который известно: - воздух на 78% состоит из простого веще
Даны буквы: Р, З, И, О, А, П, Т, М. В этих буквах спрятано название элемента, про который известно: - воздух на 78% состоит из простого веще Химическое загрязнение окружающей среды
Химическое загрязнение окружающей среды Сернистый ангидрид SO2. Диоксид серы
Сернистый ангидрид SO2. Диоксид серы Нефтяные масла. Основная информация
Нефтяные масла. Основная информация Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Алкендер – қаныпаған көмірсутектер. Алынуы, химиялық қасиеттері және қолданылуы
Алкендер – қаныпаған көмірсутектер. Алынуы, химиялық қасиеттері және қолданылуы Тротуарная плитка, генерирующая электричество
Тротуарная плитка, генерирующая электричество Любовь, что движет Солнце и Светила Интегрированный урок по химии и литературе Подготовили: учитель химии Акимова О.В.
Любовь, что движет Солнце и Светила Интегрированный урок по химии и литературе Подготовили: учитель химии Акимова О.В.  Виды присадок к моторному топливу. Керосин
Виды присадок к моторному топливу. Керосин Проблема химического элемента. Концепции структуры химических соединений
Проблема химического элемента. Концепции структуры химических соединений Гальванические элементы
Гальванические элементы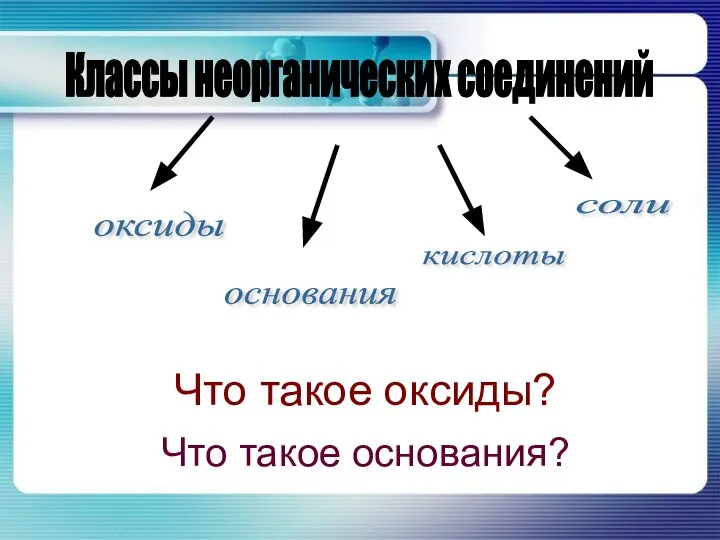 Что такое оксиды?
Что такое оксиды? Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая
Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая Регуляция обменных процессов. Гормоны
Регуляция обменных процессов. Гормоны История одного открытия
История одного открытия  Водород.Кислоты.Соли
Водород.Кислоты.Соли Получение азокрасителя в лабораторных условиях
Получение азокрасителя в лабораторных условиях Презентация по Химии "Закон сохранения массы вещества" - скачать смотреть
Презентация по Химии "Закон сохранения массы вещества" - скачать смотреть  Органическая химия. Пособие
Органическая химия. Пособие Технологии получения полимерных пленок
Технологии получения полимерных пленок