Содержание
- 2. Содержание Основные понятия химической термодинамики Внутренняя энергия. Первое начало термодинамики Тепловые эффекты химических реакций. Энтальпия Основы
- 3. Химическая термодинамика изучает переходы энергии из одной формы в другую, от одной части системы к другой
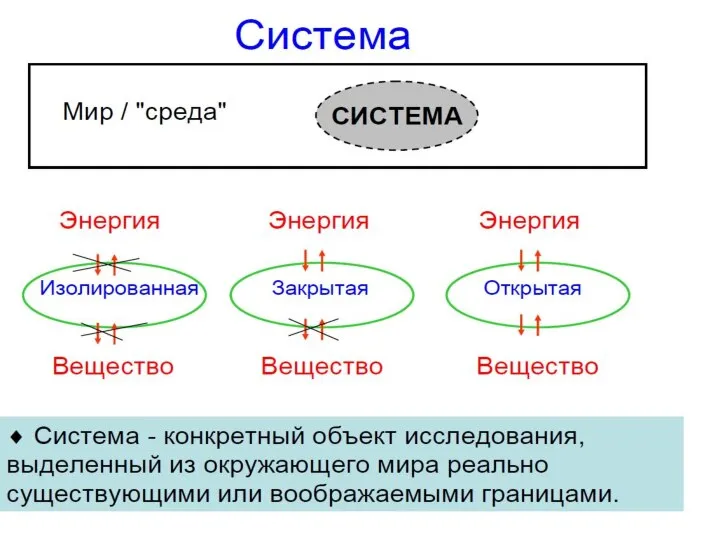
- 4. Основные понятия химической термодинамики Система – вещество или совокупность веществ, находящихся во взаимодействии, реально или мысленно
- 5. Типы систем по характеру взаимодействия с внешней средой Открытая – система, для которой возможен обмен веществом
- 11. Взаимосвязь между параметрами системы – уравнение состояния Пример: уравнение состояния идеального газа (уравнение Клапейрона-Менделеева) Параметры состояния
- 12. Функции состояния внутренняя энергия U энтальпия H энтропия S энергия Гиббса G Свойства функций состояния: численные
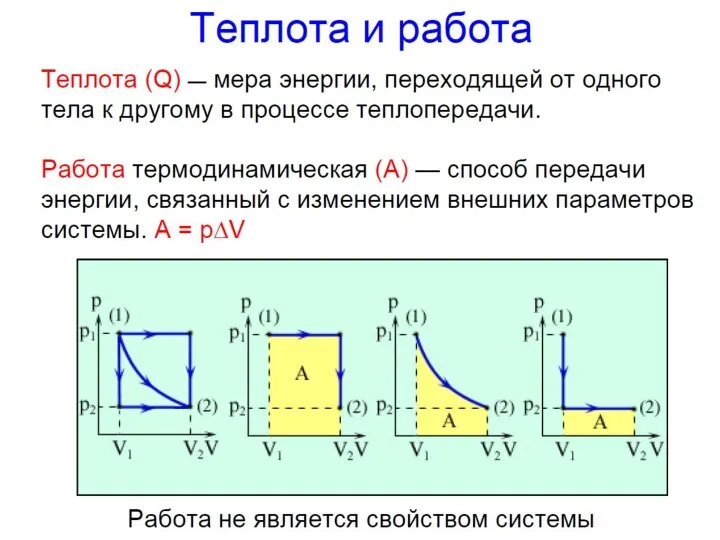
- 13. Внутренняя энергия (U) - сумма кинетической энергии движения и потенциальной энергии взаимодействия структурных единиц (молекул, атомов,
- 20. ► Изохорический процесс – процесс, происходящий в физической системе при постоянном объеме (V = const). -
- 21. ► Изобарический процесс – процесс, происходящий в физической системе при постоянном давлении (P = const). -
- 22. ► Изобарический процесс – процесс, происходящий в физической системе при постоянном давлении (P = const). -
- 23. Стандартные условия Все вещества, участвующие в реакции, чистые Температура 298 К Парциальные давления газов или атмосферное
- 24. Термохимические уравнения - уравнения химических реакций, записанные с указанием значения энтальпии ΔH (кДж) и агрегатного состояния
- 25. Энтальпия образования - энтальпия реакции образования одного моля данного вещества из простых веществ, устойчивых в стандартных
- 26. Закон Гесса энтальпии реакций, протекающих при постоянном давлении или при постоянном объеме, не зависят от пути
- 28. 2Fe(к) + 3/2 O2(г) = Fe2O3(к), 2Fe(к) + O2(г) = 2FeO(к), 2FeO(к) + 1/2O2(г) = Fe2O3(к),
- 29. Расчет стандартной энтальпии реакции FeO(к) + H2(г) = Fe(к) + H2O(г) (1) по известным термохимическим уравнениям
- 30. Закон Гесса. Следствие 1 Энтальпия реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ
- 36. Заключение Химическая термодинамика изучает энергетические эффекты химических реакций Объектами изучения химической термодинамики являются разнообразные системы, для
- 38. Скачать презентацию

































 Твёрдые жиры
Твёрдые жиры Спирты. Состав и строение спиртов
Спирты. Состав и строение спиртов Презентация по Химии "Задания на соответствие" - скачать смотреть
Презентация по Химии "Задания на соответствие" - скачать смотреть  Model chemistry
Model chemistry Тұздар гидролизі
Тұздар гидролизі Полимеры. Степень полимеризации
Полимеры. Степень полимеризации Углеводороды. Алкены
Углеводороды. Алкены Виды присадок к моторным топливам. Керосин
Виды присадок к моторным топливам. Керосин Р-элементы III группы
Р-элементы III группы Phase formation rules for high entropy alloys
Phase formation rules for high entropy alloys Кислоты и соли. (8 класс)
Кислоты и соли. (8 класс) Визначення якості мила за його лужністю
Визначення якості мила за його лужністю Консистентные смазки для легковых автомобилей
Консистентные смазки для легковых автомобилей Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Vodík
Vodík Көміртегінің мөлшері бойынша легірленген болаттың классификациясы
Көміртегінің мөлшері бойынша легірленген болаттың классификациясы Разработка реактора для отопления домов путем извлечения водорода из воды
Разработка реактора для отопления домов путем извлечения водорода из воды Турнир юных химиков
Турнир юных химиков Жоғары температурағы асқын өткізгіштер
Жоғары температурағы асқын өткізгіштер Группа редкоземельных элементов
Группа редкоземельных элементов Материалы с особыми тепловыми свойствами
Материалы с особыми тепловыми свойствами Рафинирование металлических расплавов
Рафинирование металлических расплавов Физическая и коллоидная химия
Физическая и коллоидная химия Кислотность и основность рганических соединений. Инфракрасная спектроскопия
Кислотность и основность рганических соединений. Инфракрасная спектроскопия Проверка знаний по теме «Белки, состав, структура, функции» (работа на 10-12 минут)
Проверка знаний по теме «Белки, состав, структура, функции» (работа на 10-12 минут) Химиялық реакцияның жылдамдығы. Катализ
Химиялық реакцияның жылдамдығы. Катализ Хімічні добавки. Е-числа Підготувала Учениця 11-А класу Макарівського НВК Заріцька Вікторія Вчитель:Гребенюк Олександра Іва
Хімічні добавки. Е-числа Підготувала Учениця 11-А класу Макарівського НВК Заріцька Вікторія Вчитель:Гребенюк Олександра Іва Адсорбция. Адсорбциондық тепе-теңдік
Адсорбция. Адсорбциондық тепе-теңдік