Содержание
- 2. Физические свойства элементов IIА группы
- 3. Учебная цель: 10.2.1.10 объяснять закономерности изменения физических свойств элементов 2 (II) группы
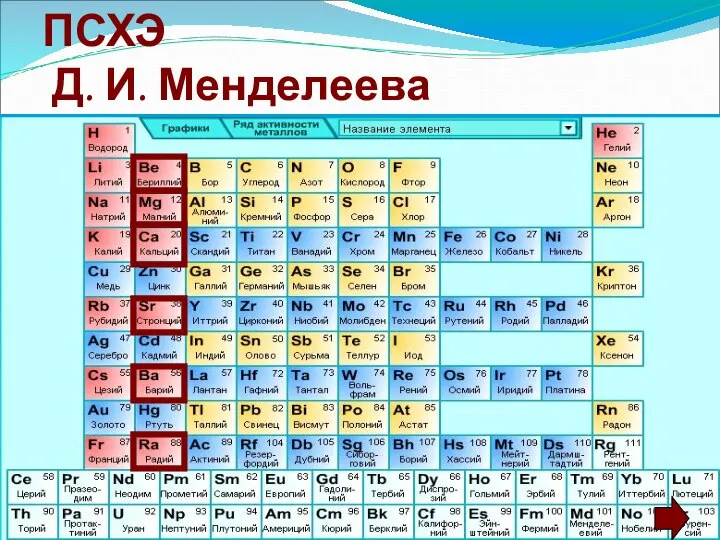
- 4. Положение элементов в ПСХЭ Д. И. Менделеева
- 5. Щелочноземельные металлы В главную подгруппу II группы входят бериллий Be, магний Mg, кальций Са, стронций Sr,
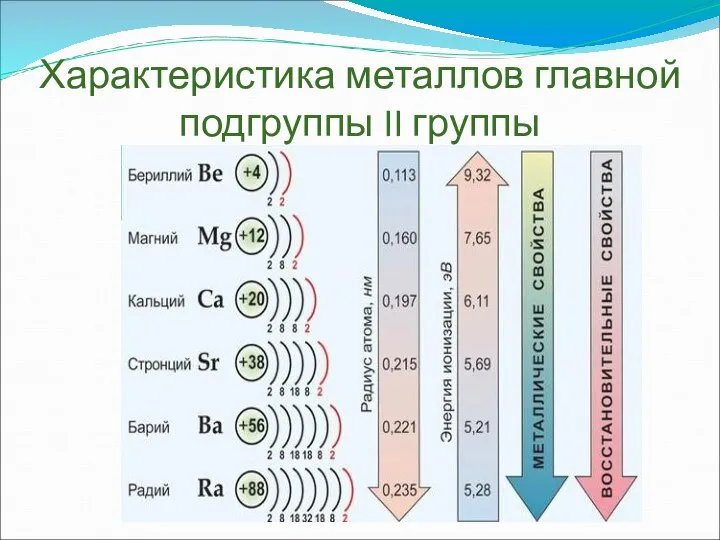
- 6. Характеристика металлов главной подгруппы II группы
- 7. Объяснение Радиус атомов металлов II(А) группы сверху вниз увеличивается, так как увеличивается число энергетических уровней; Энергия
- 8. Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя nS2 Элементы проявляют степень
- 9. Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент
- 10. Be – светло-серый, твердый, хрупкий Ca – твердый, пластичный Mg – относительно мягкий, пластичный, ковкий Sr
- 11. Физические свойства Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. Они более твёрдые, чем
- 12. Строение металлической кристаллической решетки
- 13. Нахождение в природе - В свободном состоянии не встречаются. Самым распространённым щелочноземельным металлом является кальций, 3,38
- 14. Найди соответствие 1. Ca 2. Sr 3. Ba А) Гране-центрированная кубическая решетка Б) Объемно-центрированная кубическая решетка
- 15. Задание: сравнить знаками > или
- 16. Критерий оценивания: знает периодическое изменение свойств атомов в группе. Дескриптор: Сравнивает радиус атомов (1 балл); Сравнивает
- 18. Скачать презентацию













 Природные источники углеводородов и топливные ресурсы Западной Сибири
Природные источники углеводородов и топливные ресурсы Западной Сибири Презентация по Химии "Мышьяк – As" - скачать смотреть
Презентация по Химии "Мышьяк – As" - скачать смотреть  Қышқылдық және негіздік теориясы. Қанның рН анықтау жолдары. Қанның буферлік үйесі
Қышқылдық және негіздік теориясы. Қанның рН анықтау жолдары. Қанның буферлік үйесі КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ
КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ Електрофорез
Електрофорез Уравнения химической реакции 8 класс
Уравнения химической реакции 8 класс Составил: учитель химии Составил: учитель химии МОУ «Бурханкульская ООШ» Кулешова С.Е.
Составил: учитель химии Составил: учитель химии МОУ «Бурханкульская ООШ» Кулешова С.Е. Ионная химическая связь
Ионная химическая связь Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород
Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород Малахит
Малахит Алкины. Гомологический ряд алкинов
Алкины. Гомологический ряд алкинов Презентация по Химии "Простые вещества-неметаллы" - скачать смотреть
Презентация по Химии "Простые вещества-неметаллы" - скачать смотреть  Спирти. Історична довідка
Спирти. Історична довідка Атомның кванты – механикалық моделі. Квант сандары
Атомның кванты – механикалық моделі. Квант сандары Каталітичні процеси нафтопереробки
Каталітичні процеси нафтопереробки Небезпечні речовини
Небезпечні речовини Строение атома
Строение атома Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы
Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Типы химических реакций
Типы химических реакций  Подготовка к ГИА. А15. Вычисление массовой доли химического элемента в веществе
Подготовка к ГИА. А15. Вычисление массовой доли химического элемента в веществе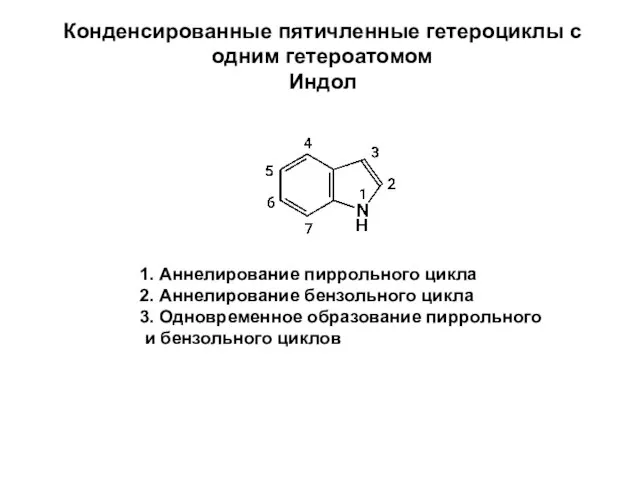 Конденсированные пятичленные гетероциклы с одним гетероатомом. Индол
Конденсированные пятичленные гетероциклы с одним гетероатомом. Индол Тонколистовой металл и проволока
Тонколистовой металл и проволока Основные сырьевые материалы для производства портландцемента
Основные сырьевые материалы для производства портландцемента Показатели КЩС крови
Показатели КЩС крови Гликоконъюгаты: структура и функции протеогликанов и гликопротеинов
Гликоконъюгаты: структура и функции протеогликанов и гликопротеинов Свойства алмаза
Свойства алмаза Аттестационная работа. Компьютерная программа оценивания курсовой работы студентов по общей и неорганической химии
Аттестационная работа. Компьютерная программа оценивания курсовой работы студентов по общей и неорганической химии