Содержание
- 2. Открытие фосфора Гамбургский алхимик Хеннинг Бранд 1669 год «Фосфор» - от греческого «светоносный»
- 3. Алхимик Х.Бранд, пытаясь отыскать «философский камень», получил удивительное вещество. Оказалось, что это был фосфор .
- 4. Фосфор – простое вещество. 1.Химическая формула – Р. 2.Mr(Р) =31 3. М (Р) = 31г/моль 4.
- 5. Апати́т (от др.-греч. ἀπατάω «обманываю») — минерал класса фосфатов, как правило, бледно-зеленоватого, голубого, желто-зеленого или розового
- 6. Белый фосфор
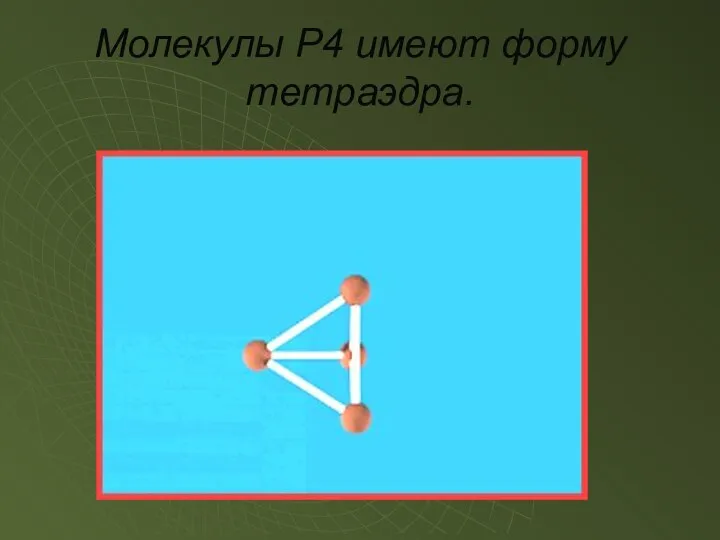
- 7. Молекулы P4 имеют форму тетраэдра.
- 8. Желтый фосфор
- 9. Красный фосфор
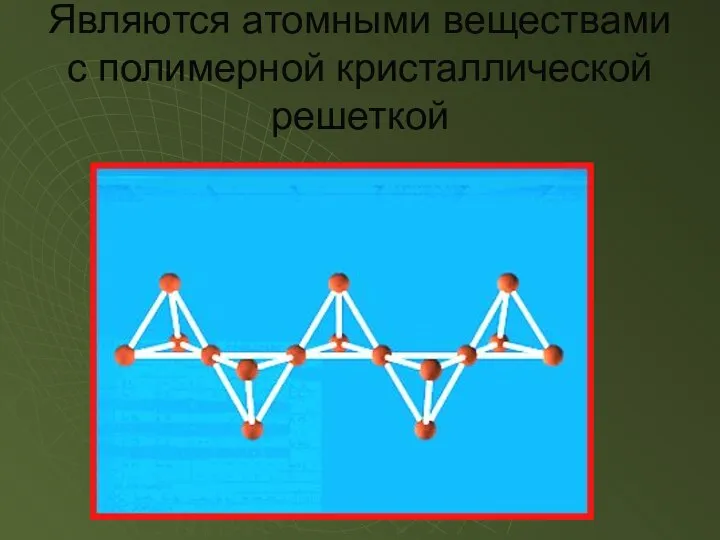
- 10. Являются атомными веществами с полимерной кристаллической решеткой
- 11. Черный фосфор
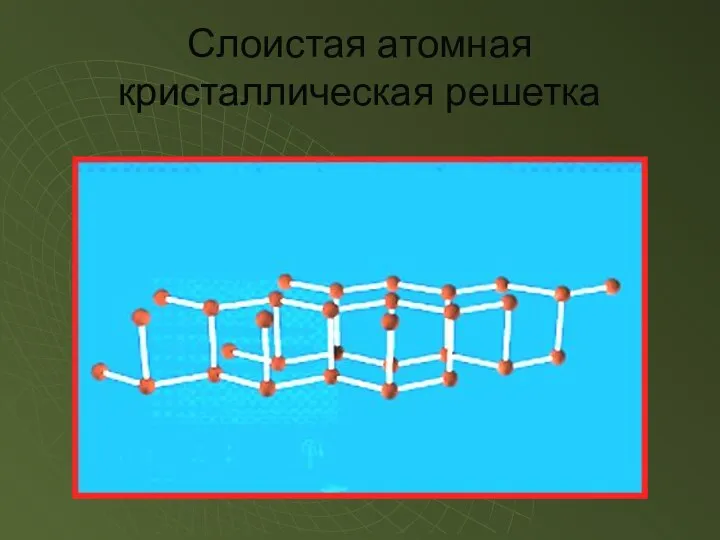
- 12. Слоистая атомная кристаллическая решетка
- 13. Металлический фосфор
- 14. Химические свойства Взаимодействие с простыми веществами Фосфор легко окисляется кислородом Взаимодействует со многими простыми веществами —
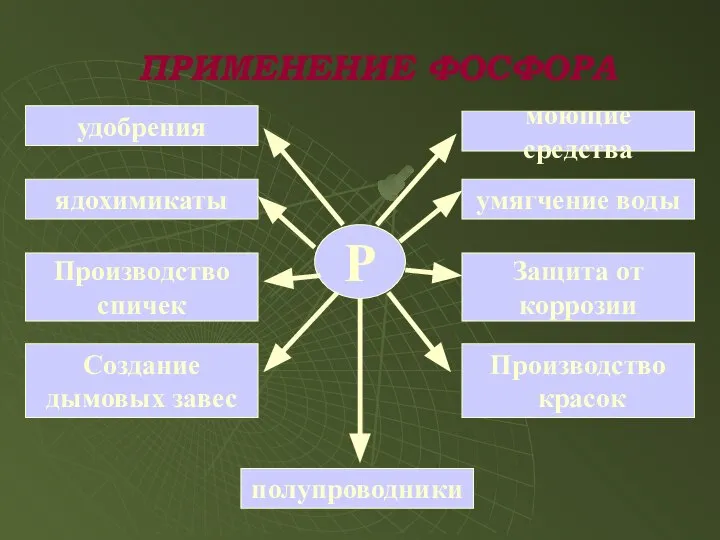
- 15. ПРИМЕНЕНИЕ ФОСФОРА Р удобрения ядохимикаты Производство спичек Создание дымовых завес полупроводники Производство красок Защита от коррозии
- 16. Войска США использовали фосфорные Бомбы в Ираке, 2004 г.
- 17. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ, ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫ В ЗУБАХ И КОСТЯХ ФОСФОРИТ БИРЮЗА
- 19. Скачать презентацию












 Классы неорганических соединений
Классы неорганических соединений Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений
Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений Тема 8. Ювелирные товары
Тема 8. Ювелирные товары Материаловедение. Строение и основные свойства металлов
Материаловедение. Строение и основные свойства металлов Кристалл. Основные законы кристаллографии
Кристалл. Основные законы кристаллографии Лекарственное растительное сырье, содержащее производные простых фенолов
Лекарственное растительное сырье, содержащее производные простых фенолов “Физикалық химия” курсы бойынша жеке бағдарланған индивидуалды зерттеу жұмысы
“Физикалық химия” курсы бойынша жеке бағдарланған индивидуалды зерттеу жұмысы Опасные химикаты
Опасные химикаты Химия d -элементов
Химия d -элементов Օզոն. Օզոնային շերտ
Օզոն. Օզոնային շերտ Хімічна еволюція Даниленко Альона 11-А
Хімічна еволюція Даниленко Альона 11-А  Спирты Предельные одноатомные спирты
Спирты Предельные одноатомные спирты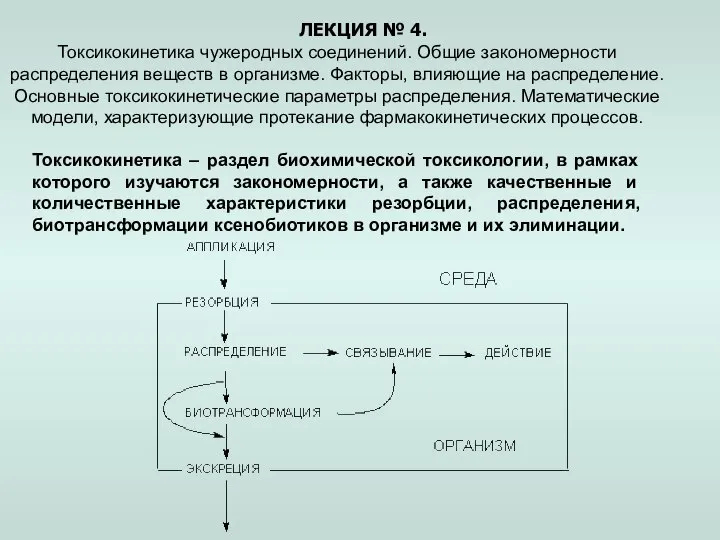 Токсикокинетика чужеродных соединений. Закономерности распределения веществ в организме. (Лекция 4)
Токсикокинетика чужеродных соединений. Закономерности распределения веществ в организме. (Лекция 4) Квалификация химических реактивов, принятая в РФ
Квалификация химических реактивов, принятая в РФ Способы и системы культивирования микроорганизмов. (Тема 3)
Способы и системы культивирования микроорганизмов. (Тема 3) Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Imperfections in Solids
Imperfections in Solids Алкалоиды, производные тропана
Алкалоиды, производные тропана Спазган: применение, форма, свойства, состав
Спазган: применение, форма, свойства, состав Электроизоляционные лаки, эмали, компаунды
Электроизоляционные лаки, эмали, компаунды Неорганические вещества. Оксиды, кислоты, соли, основания
Неорганические вещества. Оксиды, кислоты, соли, основания Презентация по Химии "Угольная кислота и ее соли" - скачать смотреть
Презентация по Химии "Угольная кислота и ее соли" - скачать смотреть 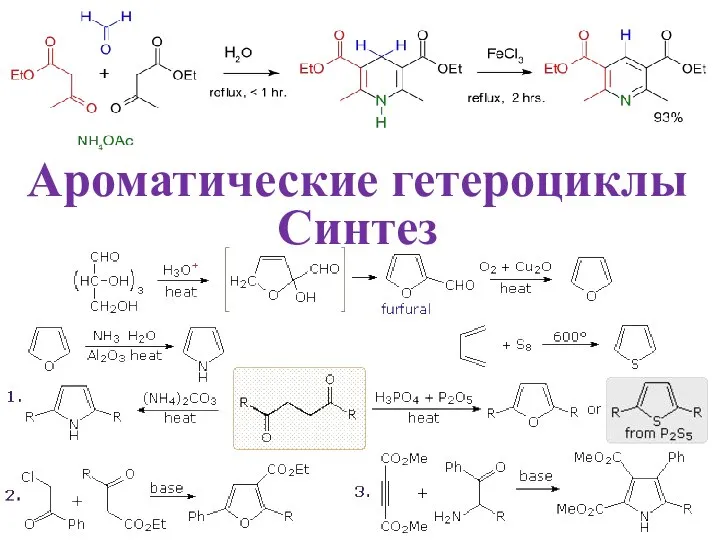 Ароматические гетероциклы. Синтез
Ароматические гетероциклы. Синтез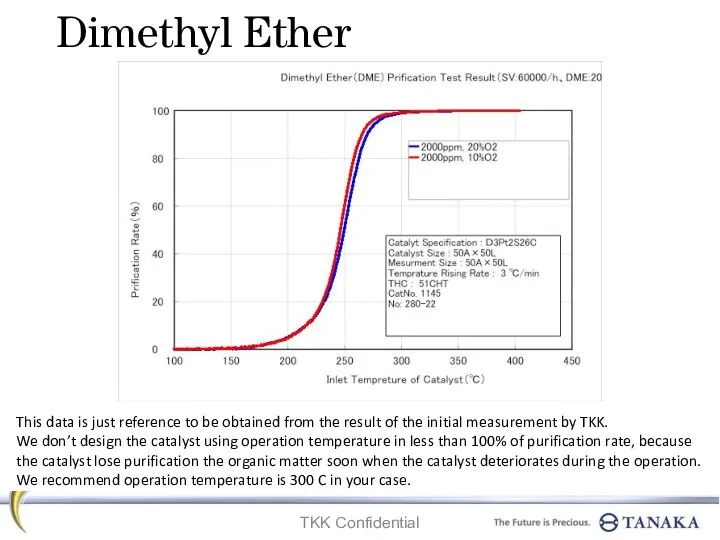 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Сложные вещества кислоты
Сложные вещества кислоты Природные смолы: мирра, ладан и шеллак
Природные смолы: мирра, ладан и шеллак Стекло, его происхождение и значение в жизни человека
Стекло, его происхождение и значение в жизни человека Ліпіди. Класифікація ліпідів
Ліпіди. Класифікація ліпідів