Содержание
- 2. ОКСИД ФОСФОРА (V) Физические свойства: Белый гигроскопичный порошок. Получение: Горение фосфора в воздухе или кислороде 4P+
- 3. Химические свойства Определите характер оксида? 1) С основными оксидами: P2O5 + CaO = 2) С основаниями:
- 4. Ортофосфорная кислота H3PO4
- 5. Физические свойства Бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
- 6. Получение 1. Взаимодействие оксида фосфора (V) с водой при нагревании P2O5 + H2O = 2. Взаимодействие
- 7. Химические свойства Диссоциирует на ионы: H3PO4 ↔ 2. C металлами не взаимодействует. Почему? 3. С основными
- 8. Химические свойства 5) С солями слабых кислот: H3PO4 + Na2CO3 = 6) С аммиаком: H3PO4 +
- 9. Качественная реакция на фосфат ион При взаимодействии с нитратом серебра образуется желтый осадок H3PO4 + 3AgNO3
- 10. Применение Производство минеральных удобрений; При пайке, для очищения от ржавчины металлических изделий; 3. В составе фреонов
- 11. Закрепление 1.Осуществите превращение: P →PH3→P2O5→H3PO4→Ca3(PO4)2 2. Вычислите (в %) какое из фосфорных удобрений: двойной суперфосфат или
- 13. Скачать презентацию










 Химия повсюду окружает человека
Химия повсюду окружает человека Basis Sets and Pseudopotentials
Basis Sets and Pseudopotentials Основні поняття хімічної термодинаміки
Основні поняття хімічної термодинаміки Физические свойства металлов: пластичность, электропроводность, теплопроводность, металлический блеск, плотность
Физические свойства металлов: пластичность, электропроводность, теплопроводность, металлический блеск, плотность ОГЭ №2, вопрос 1-16
ОГЭ №2, вопрос 1-16 Сероводород, сернистый водород
Сероводород, сернистый водород Мышьяк (лат. аrsenicum)
Мышьяк (лат. аrsenicum) Реакции разложения
Реакции разложения Строение атома. (Лекция 2-3)
Строение атома. (Лекция 2-3) Области применения спиртов
Области применения спиртов Строение атома. Химическая связь
Строение атома. Химическая связь ОГЭ химия 2021 задание 13
ОГЭ химия 2021 задание 13 Неделя специальности "Аналитический контроль качества химических соединений"
Неделя специальности "Аналитический контроль качества химических соединений" Производство фенолформальдегидной смолы
Производство фенолформальдегидной смолы Iodine
Iodine Презентация по Химии "Химия и сельское хозяйство. Пестициды" - скачать смотреть
Презентация по Химии "Химия и сельское хозяйство. Пестициды" - скачать смотреть  Внесение удобрений разбрасыванием
Внесение удобрений разбрасыванием Материаловедение. Свойства материалов. (Тема 2)
Материаловедение. Свойства материалов. (Тема 2) Карбоновые кислоты. Модели молекул
Карбоновые кислоты. Модели молекул Минерал клинохлор. Месторождения
Минерал клинохлор. Месторождения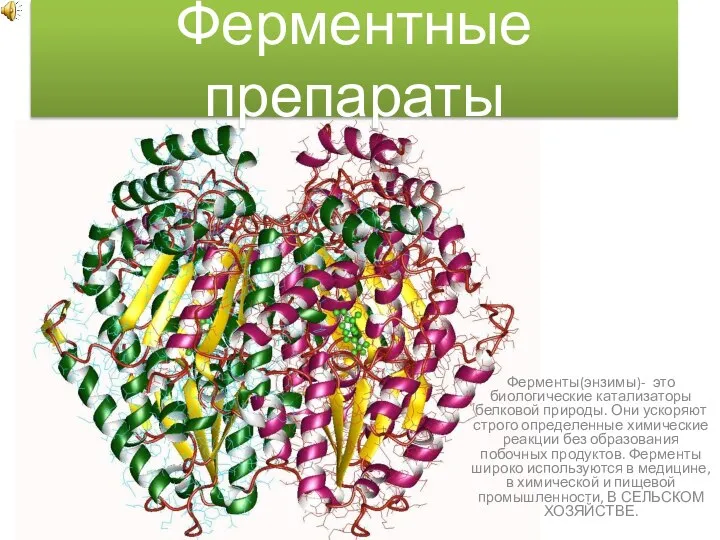 Ферментные препараты
Ферментные препараты Группы сходных химических элементов
Группы сходных химических элементов Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Металдарға қандай физикалық қасиеттер тән?
Металдарға қандай физикалық қасиеттер тән? Полимеры. Каучуки. Резина
Полимеры. Каучуки. Резина Ионная связь
Ионная связь Каталитический крекинг
Каталитический крекинг Бронза. Свойства
Бронза. Свойства