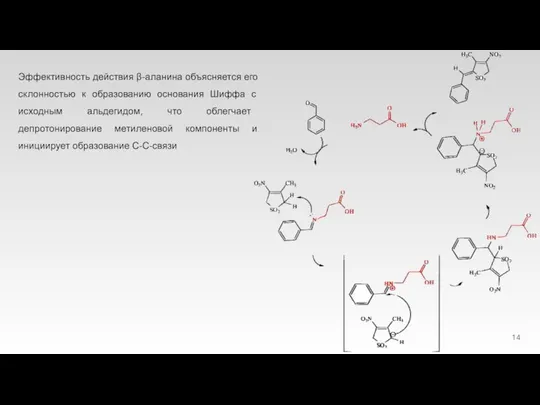
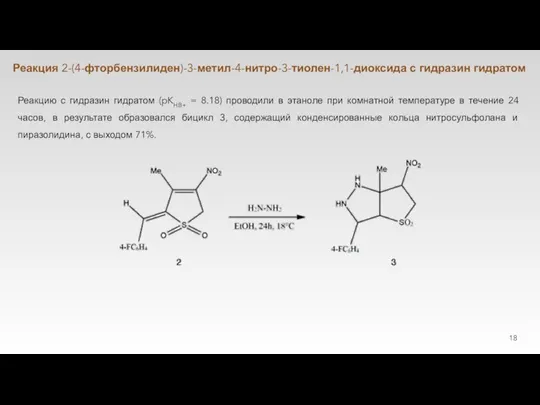
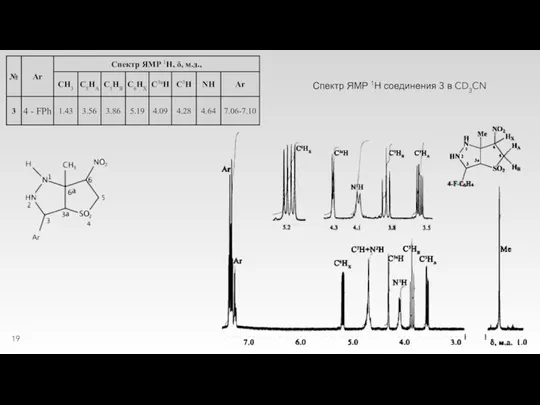
Слайд 21

ЛИТЕРАТУРА
V. M. Berestovitskaya, M. V. Selivanova, M. I. Vakulenkio, I.
E. Efremova and G. A. Berkova. Reactions of 2-Benzylidene-3-methyl-4-nitro-2,5-dihydro- thiophene 1,1-Dioxide with CH Acids // Russian Journal of Organic Chemistry, 2009, Vol. 45, No. 12, pp. 1814–1817.
Игорь И. Савельев, Ирина Е. Ефремова, Владислав В. Гуржий, Руслан И. Байчурин. Синтез сульфоланооктагидрохроменонов на основе 2-бензилиден-3-метил-4-нитро-2,5-дигидротиофен-1,1-диоксидов // Химия гетероциклических соединений 2022, 58(1), 58–63.
Берестовицкая В.М., Ефремова И.Е., Трухин Е.В., Беркова Г.А. Изомерные превращения в ряду замещенных 4-нитро-2- и 3-тиолен-1,1- диоксидов // ЖОрХ. 1993. Т. 29. Вып. 2. С. 368 - 376.
Valentina M. Berestovitskaya, Irina E. Efremova, Lidiya V. Lapshina, Anna V. Serebryannikova, Vladislav V. Gurzhiy and Victoria V. Abzianidze. Synthesis of 3-aryl-6a-methyl-6-nitro-1-phenyl- hexahydrothieno[2,3-d]pyrazole 4,4-dioxides // Mendeleev Commun., 2015, 25, 191–192.
Валентина М. Берестовицкая, Ирина Е. Ефремова, Анна В. Серебрянникова, Лидия В. Лапшина, Владислав В. Гуржий. Синтез бициклов с конденсированными циклами сульфолана и изоксазолидина // Химия гетероциклических соединений 2018, 54(1), 76–82.
И. Е. Ефремова, А. В. Серебрянникова, А. В. Беляков, Л. В. Лапшина. Синтез новых представителей ряда сульфоланопиразолидинов // Журнал общей химии, 2019, том 89, No 3, с. 468–471.
Берестовицкая В.М.; Ефремова И.Е.; Трухин Е.В.; Беркова Г.А. Журнал Органической Химии, 1993, 29(2), 368.








 Получение соды
Получение соды Предельные одноосновные карбоновые кислоты 9 класс
Предельные одноосновные карбоновые кислоты 9 класс Химические добавки к бетонам
Химические добавки к бетонам Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Урок по химии Тема: Соединения элементов с кислородом
Урок по химии Тема: Соединения элементов с кислородом  обратимые и необратимые реакции, электролитическая диссоциация, сильные и слабые электролиты, определение кислот, солей, основан
обратимые и необратимые реакции, электролитическая диссоциация, сильные и слабые электролиты, определение кислот, солей, основан Химическое равновесие. Азот (продолжение). 9 класс
Химическое равновесие. Азот (продолжение). 9 класс Гетерогенный катализ
Гетерогенный катализ Воздух. Постоянные компоненты воздуха
Воздух. Постоянные компоненты воздуха Особая роль углерода в наномире
Особая роль углерода в наномире Тотығу-тотықсыздану реакциялары
Тотығу-тотықсыздану реакциялары Сорбционные процессы
Сорбционные процессы Водород. Получение и свойства водорода
Водород. Получение и свойства водорода Красные камни. Пироп, альмандин, рубин, шпинель
Красные камни. Пироп, альмандин, рубин, шпинель Презентация по Химии "Презентация Подгруппа азота" - скачать смотреть
Презентация по Химии "Презентация Подгруппа азота" - скачать смотреть  Кислоты вокруг нас
Кислоты вокруг нас Численное моделирование развития возмущений в ударном слое на пластине в потоке смеси колебательно возбужденных газов
Численное моделирование развития возмущений в ударном слое на пластине в потоке смеси колебательно возбужденных газов Циклоалканы
Циклоалканы Товароведенье продовольственных товаров
Товароведенье продовольственных товаров Автоматизация объекта 901-09 – узел приема и хранения щелочи и аммиачной воды
Автоматизация объекта 901-09 – узел приема и хранения щелочи и аммиачной воды Конденсированные гетероциклические соединения. Пурины
Конденсированные гетероциклические соединения. Пурины PROTEIN PLEX. Состав
PROTEIN PLEX. Состав Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Проблемы загрязнения воды Ташбаев Далерхан 7 «А»
Проблемы загрязнения воды Ташбаев Далерхан 7 «А» Шкала рН
Шкала рН Анализ нуклеиновых кислот
Анализ нуклеиновых кислот Даны буквы: Р, З, И, О, А, П, Т, М. В этих буквах спрятано название элемента, про который известно: - воздух на 78% состоит из простого веще
Даны буквы: Р, З, И, О, А, П, Т, М. В этих буквах спрятано название элемента, про который известно: - воздух на 78% состоит из простого веще Органическая химия. Основные положения. История развития науки Королёва Инна Николаевна Учитель химии МАОУ СОШ №10 Ст. Новомыша
Органическая химия. Основные положения. История развития науки Королёва Инна Николаевна Учитель химии МАОУ СОШ №10 Ст. Новомыша